O równoważenie równań pozwala nam dopasować liczbę atomów obecnych w równaniu chemicznym, aby stało się prawdziwe i przedstawiało reakcję chemiczną.
Skorzystaj z poniższych pytań, aby sprawdzić swoją wiedzę i sprawdź odpowiedzi skomentowane po opinii, aby odpowiedzieć na swoje pytania.
Pytanie 1
(Mackenzie-SP)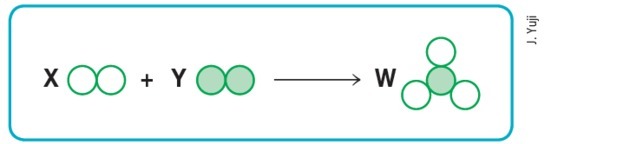
Zakładając, że puste i wypełnione kółka oznaczają odpowiednio różne atomy, to schemat powyżej będzie reprezentować zrównoważoną reakcję chemiczną, jeśli zastąpimy odpowiednio litery X, Y i W przez wartości:
a) 1, 2 i 3.
b) 1, 2 i 2.
c) 2, 1 i 3.
d) 3, 1 i 2.
e) 3, 2 i 2.
Alternatywa d) 3, 1 i 2.
I krok: Przypisujemy litery, aby równanie było łatwiejsze do zrozumienia.
Drugi krok: dodajemy indeksy, aby wiedzieć, kto ma najwięcej atomów w równaniu.
| TEN | |
| b |
A i B pojawiają się tylko raz w każdym elemencie równania. Jeśli jednak zsumujemy indeksy, zobaczymy, że A ma najwyższą wartość. Dlatego zaczęliśmy dla niego balansowanie.
Trzeci krok: Równoważymy element A, transponując wskaźniki i zamieniając je na współczynniki.
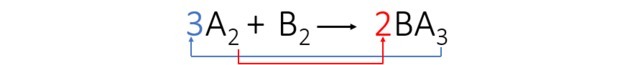
Zaobserwowaliśmy, że element B został automatycznie zrównoważony, a współczynniki równania wynoszą: 3, 1 i 2.
pytanie 2
(Unicamp-SP) Przeczytaj poniższe zdanie i przekształć je w (zbilansowane) równanie chemiczne, używając symboli i wzorów: „cząsteczka azotu gazowego, zawierająca dwa atomy azotu na cząsteczkę, reaguje z trzema cząsteczkami dwuatomowego, gazowego wodoru, wytwarzając dwie cząsteczki gazowego amoniaku, który składa się z trzech atomów wodoru i jednego z azot".
Odpowiadać:
Reprezentując atomy opisane w pytaniu, możemy zrozumieć, że reakcja zachodzi w następujący sposób:
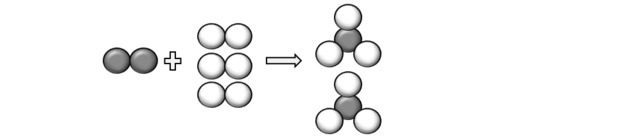
Dochodzimy więc do równania:
pytanie 3
Zgodnie z poniższym równaniem chemicznym nadtlenek wodoru to związek chemiczny, który może się rozkładać, tworząc wodę i tlen.
Jeśli chodzi o tę reakcję, prawidłowo zbilansowane równanie to:
a) H2O2 →2 + H2O
b) 2h2O2 →2 + 2 godz2O
c) H2O2 → 2O2 + H2O
d) 2h2O2 → 2O2 + 2 godz2O
Prawidłowa alternatywa: b) 2H2O2 →2 + 2 godz2O
Zauważ, że nadtlenek wodoru jest substancją chemiczną składającą się z atomów dwóch pierwiastków chemicznych: wodoru i tlenu.
Po reakcji rozkładu musisz mieć taką samą liczbę atomów obu pierwiastków zarówno w substratach, jak i produktach. W tym celu musimy zrównoważyć równanie.
Zauważ, że w reagentach mamy 2 atomy wodoru (H2O2) i dwa atomy w produkcie (H2O). Jednak tlen ma dwa atomy w reagentach (H2O2) i trzy atomy w produktach (H2O i O2).
Jeśli umieścimy współczynnik 2 przed nadtlenkiem wodoru, podwajamy liczbę atomów w pierwiastkach.
Zauważ, że jeśli połączymy ten sam współczynnik ze wzorem na wodę, będziemy mieli taką samą ilość atomów po obu stronach.
Dlatego prawidłowo zbilansowane równanie chemiczne to 2H2O2 →2 + 2 godz2O.
pytanie 4
(UFPE) Rozważ poniższe reakcje chemiczne.
Możemy to powiedzieć:
a) wszystkie są zrównoważone.
b) 2, 3 i 4 są zrównoważone.
c) tylko 2 i 4 są zrównoważone.
d) tylko 1 jest niesymetryczne.
e) żaden nie jest prawidłowo zrównoważony, ponieważ stany fizyczne reagentów i produktów są różne.
Alternatywa b) 2, 3 i 4 są zrównoważone.
Alternatywy 1 i 5 są nieprawidłowe, ponieważ:
- Równanie 1 jest niezrównoważone, prawidłowe saldo to:
- Równanie 5 jest nieprawidłowe, ponieważ związkiem powstałym w reakcji będzie H2TYLKO3.
Aby utworzyć H2TYLKO4 należy uwzględnić w równaniu utlenianie SO2.
pytanie 5
(Mackenzie-SP) Podgrzany do 800 °C węglan wapnia rozkłada się na tlenek wapnia (wapno pierwotne) i dwutlenek węgla. Prawidłowo zbilansowane równanie, które odpowiada opisanemu zjawisku, to:
(Podano: Ca — metal ziem alkalicznych.)
Alternatywa c)
Wapń jest metalem ziem alkalicznych i aby mieć stabilność, wapń potrzebuje 2 elektronów (Ca2+), czyli ładunek tlenu (O2-).
W ten sposób atom wapnia wiąże się z atomem tlenu, a powstałym związkiem jest CaO, czyli wapno palone.
Drugim produktem jest dwutlenek węgla (CO2). Oba są tworzone przez węglan wapnia (CaCO3).
Układając to w równaniu:
Zauważamy, że ilości atomów są już prawidłowe i nie wymagają równoważenia.
pytanie 6
(UFMG) Równanie nie jest zrównoważony. Bilansując ją jak najmniejszymi liczbami, suma współczynników stechiometrycznych wyniesie:
a) 4
b) 7
c) 10
d) 11
e) 12
Alternatywa e) 12
Korzystając z metody próbnej, kolejność bilansowania będzie:
Pierwszy krok: Ponieważ pierwiastek, który pojawia się tylko raz w każdym członku i ma najwyższy indeks, to wapń, zaczęliśmy go balansować.
Drugi krok: Podążamy za balansowaniem przez radykalne PO43-, który również pojawia się tylko raz.
3 krok: równoważymy wodór.
Dzięki temu obserwujemy, że ilość tlenu została automatycznie dostosowana, a bilans równania jest następujący:
Pamiętając, że gdy współczynnik wynosi 1, nie trzeba go wpisywać do równania.
Dodając współczynniki mamy:
pytanie 7
Spalanie to rodzaj reakcji chemicznej, w której energia uwalniana jest w postaci ciepła.
Podczas całkowitego spalania substancji utworzonej przez węgiel i wodór powstaje dwutlenek węgla i woda.
Obserwuj reakcje spalania węglowodorów i odpowiedz, które z poniższych równań jest nieprawidłowo wyważone:
a) CH4 + 2O2 → CO2 + 2 godz2O
pne3H8 +502 → 3CO2 + 4 godz2O
c) C4H10 +13/3O2 → 4CO2 + 5h2O
d) C2H6 + 7/2O2 → 2CO2 + 3 godz2O
Odpowiedź nieprawidłowa: c) C4H10 +13/3O2 → 4CO2 + 5h2O
Aby zrównoważyć równania chemiczne, przyjrzyjmy się najpierw, który pierwiastek pojawia się tylko raz w każdym elemencie równania.
Zauważ, że węgiel i wodór tworzą tylko jeden reagent i jeden produkt w każdym przedstawionym równaniu.
Zacznijmy więc balansowanie od wodoru, ponieważ ma on większą liczbę atomów.
Dlatego kolejność bilansowania będzie następująca:
- Wodór
- Węgiel
- Tlen
Wodór
Ponieważ produkt ma 2 atomy wodoru, wstawiamy liczbę jako współczynnik, który pomnożony przez 2 daje wynik liczbę atomów wodoru w odczynniku.
a) CH4 + O2 → CO2 + 2H2O
pne3H8 + O2 → CO2 + 4H2O
c) C4H10 + O2 → CO2 + 5H2O
d) C2H6 + O2 → CO2 + 3H2O
Węgiel
Bilansowanie odbywa się poprzez transpozycję indeksu węglowego w odczynniku i wykorzystanie go jako współczynnika na produkcie zawierającym atomy tego pierwiastka.
a) CH4 + O2 → 1WSPÓŁ2 + 2 godz2O
pne3H8 + O2 → 3WSPÓŁ2 + 4 godz2O
c) C4H10 + O2 → 4WSPÓŁ2 + 5h2O
d) C2H6 + O2 → 2WSPÓŁ2 + 3 godz2O
Tlen
Dodając liczbę atomów tlenu w powstałych produktach, znajdujemy liczbę atomów pierwiastka, który musi reagować.
W tym celu musimy jako współczynnik podać liczbę, która pomnożona przez 2 daje liczbę atomów tlenu w produktach.
a) CH4 + O2 → 1CO2 + 2 godz2O
2x = 2 + 2
2x = 4
x = 2
Więc poprawne równanie to: CH4 + 2O2 → 1CO2 + 2 godz2O.
pne3H8 + O2 → 3CO2 + 4 godz2O
2x = 6 + 4
2x = 10
x = 5
Więc poprawne równanie to: C3H8 + 5O2 → 3CO2 + 4 godz2O
c) C4H10 + O2 → 4CO2 + 5h2O
2x = 8 + 5
2x = 13
x = 13/2
Więc poprawne równanie to: C4H10 + 13/2O2 → 4CO2+ 5h2O
d) C2H6 + O2 → 2CO2 + 3 godz2O
2x = 4 + 3
2x = 7
x = 7/2
Więc poprawne równanie to: C2H6 + 7/2O2 → 2CO2 + 3 godz2O
Prawidłowo zbilansowane równania to:
a) CH4 + 2O2 → CO2 + 2 godz2O
pne3H8 +502 → 3CO2 + 4 godz2O
c) C4H10 + 13/2O2 → 4CO2 + 5h2O
d) C2H6 + 7/2O2 → 2CO2 + 3 godz2O
Zatem alternatywa c) C4H10 +13/3O2 → 4CO2 + 5h2Chodzi o to, że nie ma właściwej równowagi.
pytanie 8
(Enem 2015) Wapienie to materiały składające się z węglanu wapnia, który może pełnić funkcję sorbentu dla dwutlenku siarki (SO2), ważne zanieczyszczenie powietrza. Reakcjami zachodzącymi w tym procesie są aktywacja kamienia wapiennego poprzez kalcynację i wiązanie SO2 z utworzeniem soli wapniowej, co ilustrują uproszczone równania chemiczne.
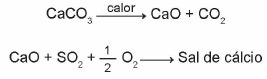
Biorąc pod uwagę reakcje zachodzące w tym procesie odsiarczania, wzór chemiczny soli wapnia odpowiada:
Alternatywa b)
Ponieważ reakcja jest zrównoważona, atomy zawarte w reagentach muszą być w tej samej ilości w produktach. A zatem,
Powstała sól składa się z:
1 atom wapnia = Ca
1 atom siarki = S
4 atomy tlenu = O4
Dlatego wzór chemiczny soli wapnia odpowiada CaSO4.
pytanie 9
(UFPI) Reakcja X z Y jest pokazana poniżej. Określ, które równanie najlepiej reprezentuje zrównoważone równanie chemiczne.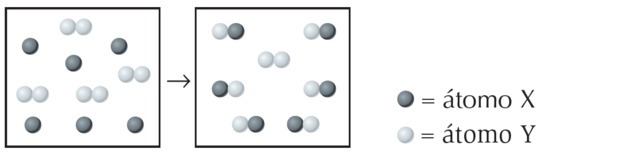
Alternatywa a)
Na rysunku widzimy, że gatunek X jest pojedynczym atomem, podczas gdy Y jest dwuatomowy, to znaczy powstaje przez połączenie 2 atomów. Więc X reaguje z Y2.
Powstały iloczyn jest reprezentowany przez XY, równanie jest niezrównoważone:
Równoważymy równanie w następujący sposób:
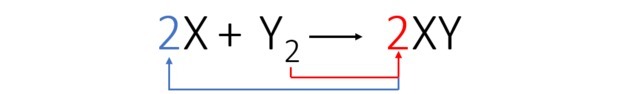
Zgodnie ze zrównoważonym równaniem poniższy rysunek pokazuje nam, jak zachodzi reakcja i jej proporcje.
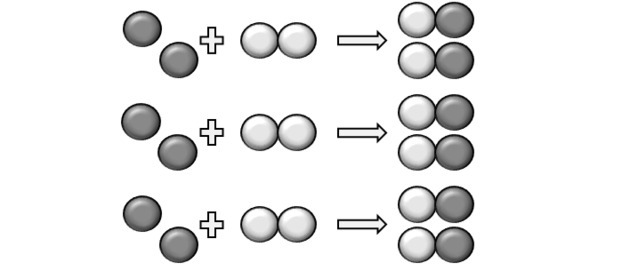
Aby reakcja zaszła, musi być ustalony stosunek i dlatego niektóre związki mogą nie reagować. Właśnie to pokazuje nam rysunek, ponieważ w produkcie widzimy, że Y2 nie zareagował.
pytanie 10
(Enem 2010) Mobilizacje w celu promowania lepszej planety dla przyszłych pokoleń są coraz częstsze. Większość środków transportu masowego jest obecnie napędzana paliwem kopalnym. Jako przykład obciążenia spowodowanego tą praktyką wystarczy wiedzieć, że samochód wytwarza średnio około 200g dwutlenku węgla na przejechany kilometr.
Magazyn globalne ocieplenie. Rok 2, 8. Publikacja Instituto Brasileiro de Cultura Ltda.
Jednym z głównych składników benzyny jest oktan (C8H18). Poprzez spalanie oktanu możliwe jest uwolnienie energii, dzięki czemu samochód ruszy. Równanie reprezentujące reakcję chemiczną tego procesu pokazuje, że:
a) w procesie uwalniany jest tlen w postaci O2.
b) współczynnik stechiometryczny dla wody wynosi 8 do 1 oktanu.
c) w procesie występuje zużycie wody, dzięki czemu uwalniana jest energia.
d) współczynnik stechiometryczny dla tlenu wynosi 12,5 do 1 oktanu.
e) współczynnik stechiometryczny dla dwutlenku węgla wynosi 9 do 1 oktanu
Alternatywnie d) współczynnik stechiometryczny dla tlenu wynosi 12,5 do 1 oktanu.
Równoważąc równanie znajdujemy następujące współczynniki:
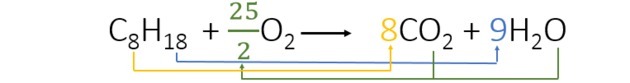
- Rozpoczęliśmy bilansowanie wodorem, który pojawia się tylko raz w każdym członku i ma wyższy indeks. Ponieważ jest 18 reagujących atomów wodoru, w produkcie są 2, więc musimy dodać liczbę, która pomnożona przez 2 daje 18. Więc 9 to współczynnik.
- Następnie dodajemy współczynnik 8 przed CO2 mieć 8 atomów węgla w każdym elemencie równania.
- Na koniec wystarczy dodać ilość tlenu w produkcie i znaleźć wartość, która pomnożona przez 2 daje nam 25 atomów tlenu. Wybraliśmy więc 25/2 lub 12,5.
Tak więc do spalania 1 oktanu zużywa się 12,5 tlenu.
pytanie 11
(Fatec-SP) Istotną cechą nawozów jest ich rozpuszczalność w wodzie. W związku z tym przemysł nawozowy przekształca fosforan wapnia, którego rozpuszczalność w wodzie jest bardzo niska, w dużo bardziej rozpuszczalny związek, jakim jest superfosfat wapnia. Proces ten przedstawia równanie:
gdzie wartości x, y i z wynoszą odpowiednio:
a) 4, 2 i 2.
b) 3, 6 i 3.
c) 2, 2 i 2.
d) 5, 2 i 3.
e) 3, 2 i 2.
Alternatywa e) 3, 2 i 2.
Stosując metodę algebraiczną tworzymy równania dla każdego pierwiastka i przyrównujemy liczbę atomów w odczynniku do liczby atomów w produkcie. W związku z tym:
Równanie zrównoważone:
pytanie 12
Zrównoważ poniższe równania metodą próbną.
Odpowiadać:
Równanie składa się z pierwiastków wodoru i chloru. Równoważymy elementy po prostu dodając współczynnik 2 przed produktem.
Równania nie trzeba było równoważyć, ponieważ ilość atomów jest już dostosowana.
Fosfor ma w reagentach dwa atomy, więc dla zbilansowania tego pierwiastka dostosowujemy ilość kwasu fosforowego w produkcie na 2H3KURZ4.
Następnie zaobserwowaliśmy, że wodór ma w produkcie 6 atomów, zrównoważyliśmy ilość tego pierwiastka, dodając współczynnik 3 do reagenta, który go zawiera.
W poprzednich krokach ilość tlenu została ustalona.
Patrząc na równanie widzimy, że ilość wodoru i bromu w produktach jest dwukrotnie większa niż jeśli jest w odczynnikach, więc dodajemy współczynnik 2 do HBr, aby zrównoważyć te dwa elementy.
Chlor ma 3 atomy w produktach i tylko 1 w reagentach, więc bilansujemy stawiając współczynnik 3 przed HCl.
Wodór miał 3 atomy w reagentach i 2 atomy w produktach. Aby dostosować wielkości, przekształcamy indeks H2 we współczynniku mnożymy przez 3, które były już w HCl i otrzymujemy wynik 6HCl.
Dostosowujemy ilości chloru w produktach tak, aby również miały 6 atomów i otrzymujemy 2AlCl3.
Aluminium miało w produktach 2 atomy, dostosowaliśmy ilość w reagentach do 2Al.
Równoważymy ilość wodoru w produkcie do 3H2 i dopasowujemy ilość 6 atomów tego pierwiastka w każdym członie równania.
W równaniu rodnik azotanowy (NO3-) ma indeks 2 w produkcie, indeks przekształcamy na współczynnik w reagentze dla 2AgNO3.
Ilość srebra wymagała dostosowania, ponieważ ma teraz 2 atomy w odczynnikach, więc mamy 2Ag w produkcie.
W reagentach mamy 4 atomy wodoru i aby zbilansować ten pierwiastek dodajemy do produktu HCl współczynnik 2.
Chlor ma teraz 4 atomy w produktach, więc dostosowujemy ilość w odczynniku do 2Cl2.
W reagentach mamy 6 atomów wodoru i aby zbilansować ten pierwiastek, dostosowujemy ilość wody do 3H2O.
W substratach mamy 2 atomy węgla i aby zbilansować ten pierwiastek dopasowujemy ilość dwutlenku węgla do 2CO2.
Tlen musi mieć 7 atomów w reagentach i aby zbilansować ten pierwiastek dostosowujemy ilość tlenu cząsteczkowego do 3O2.
Patrząc na równanie, rodnik azotanowy (NO3-) ma indeks 2 w produkcie. Przekształcamy wskaźnik na współczynnik 2 w odczynniku AgNO3.
W reagentach mamy 2 atomy srebra i aby zbilansować ten pierwiastek, dostosowujemy ilość chlorku srebra w produkcie do 2AgCl.
W produkcie mamy 3 atomy wapnia i aby zbilansować ten pierwiastek dostosowujemy ilość azotanu wapnia w odczynniku do 3Ca (NO3)2.
Pozostaje nam wtedy 6 rodników NO3- w reagentach i w celu zrównoważenia tego rodnika dostosowujemy ilość kwasu azotowego w produktach do 6HNO3.
W produktach mamy teraz 6 atomów wodoru i aby zbilansować ten pierwiastek dostosowujemy ilość kwasu fosforowego w odczynniku do 2H3KURZ4.
Dowiedz się więcej o obliczeniach z równaniami chemicznymi na:
- Bilansowanie równań chemicznych
- Stechiometria
- Obliczenia stechiometryczne
- Ćwiczenia stechiometryczne
- Ćwiczenia w układzie okresowym
