Abyś zrozumiał fenomen jonizacja najpierw trzeba wiedzieć, czym są jony. Zwróć uwagę na wyjaśnienie poniżej:
Każdy atom ma taką samą liczbę protonów i elektronów; dlatego każdy atom jest elektrycznie obojętny. Ponadto substancje utworzone przez grupy atomów mają również bilans ładunku elektrycznego, będąc elektrycznie obojętnym.
jednak, atom lub grupa atomów może stracić lub zyskać elektrony; kiedy tak się dzieje, tracą neutralność i stają się jonami.
Jeśli atom lub grupa atomów straci elektrony, będzie naładowany dodatnio i będzie jonem zwanym kation. Jeśli jednak zdobędziesz elektrony, ładunek będzie ujemny, a jon będzie a anion.
Substancje nieorganiczne są jonowe lub mają zdolność tworzenia jonów.
Jednym ze sposobów tworzenia jonów jest umieszczenie w wodzie substancji molekularnych, czyli utworzonych przez wiązania kowalencyjne, w których współdzielone są elektrony.
Na przykład, jeśli testujemy przewodnictwo elektryczne kwasu solnego (HCl) w roztworze wodnym (chlorowodór rozpuszczony w wodzie), zobaczymy, że roztwór jest elektrolityczny, to znaczy przewodzi prąd elektryczny, ponieważ są w nim jony rozwiązanie.

Oznacza to, że woda działała jako reagent, tworząc jony z kwasu solnego. Dzieje się to zgodnie z poniższą reakcją:
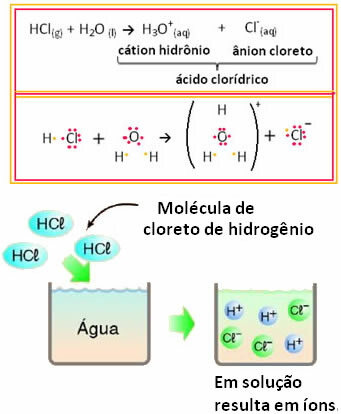
Zauważ, że przed włożeniem chlorowodoru do wody nie było jonów. Jednak jego cząsteczki przereagowały z wodą i utworzyły dodatnie jony H3O+ (kationy) i negatywy Cl- (aniony). Ponieważ chlor jest bardziej elektroujemny niż wodór, przyciąga parę elektronów z pobliskiego wiązania kowalencyjnego i tworzy anion. Z drugiej strony wodór jest przyciągany przez tlen w wodzie, który jest bardziej elektroujemny niż chlor; a pomiędzy wodorem i tlenem tworzy się wiązanie kowalencyjne, powodując powstanie kationu hydroniowego. To zjawisko tworzenia jonów nazywa sięjonizacja.
Na podstawie powyższego wyjaśnienia możemy zdefiniować jonizację w następujący sposób:

Zauważ, że jony wcześniej nie istniały, ponieważ gdyby istniały, jak w przypadku rozpuszczania związków jonowych, mielibyśmy dysocjację jonową, a nie jonizację.
Wszystkie kwasy znajdujące się w kontakcie z wodą ulegają jonizacji. Jednak nie każdy związek molekularny ulega jonizacji.Na przykład cukier (C12H22O11) jest molekularny, jednak po umieszczeniu w wodzie nie powstają jony, po prostu się rozpuszcza, tworząc nieelektrolityczny roztwór molekularny, który nie przewodzi elektryczności.
Jennifer Fogaça
Absolwent chemii


