Eksperymenty to praktyczny sposób na naukę i sprawdzenie swojej wiedzy na temat pojęć studiowanych w chemii.
Skorzystaj z tych eksperymentów chemicznych, które można wykonać w domu (pod nadzorem osoby dorosłej) lub przepracować w klasie z nauczycielem, aby uzupełnić naukę.
Pierwsze doświadczenie - rozwikłanie kolorów
Zastosowane koncepcje: chromatografia i rozdzielanie mieszanin mixture
Materiały
- długopisy (zaznaczone markery) w różnych kolorach
- alkohol
- papierowy filtr do kawy
- kubek (szklanka ułatwiająca obserwację eksperymentu)
Jak zrobić
- Użyj nożyczek i wytnij paski bibuły filtracyjnej. Dla każdego używanego długopisu zrób prostokąt.
- Teraz w odległości około 2 cm od podstawy narysuj okrąg wybranym pisakiem i pomaluj całe wnętrze.
- Przyklej krawędź papieru najdalej od narysowanego marmuru na wspornik. W tym celu możesz użyć taśmy i przymocować ją do ołówka.
- Dodaj alkohol do kubka, nie za dużo, ponieważ powinien po prostu dotykać końca papieru w pobliżu znaku pióra.
- Umieść papier w kubku tak, aby był pionowy. Ołówek, który go podtrzymuje, powinien spoczywać na krawędziach.
- Odczekaj od 10 do 15 minut, aż alkohol przebije się przez bibułę filtracyjną. Następnie wyjmij papiery i pozostaw do wyschnięcia.
Wynik
Kiedy alkohol przechodzi przez znak pisaka, wchodzi w interakcję ze składnikami koloru i przesuwa je po papierze. W ten sposób różne pigmenty zostaną rozdzielone przez kontakt z alkoholem.
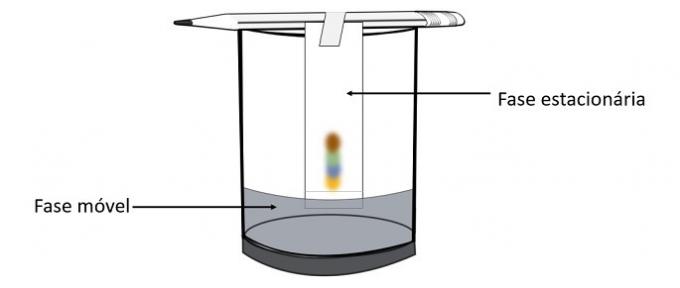
Dzięki temu eksperymentowi można dowiedzieć się, jakie kolory zostały zmieszane, aby stworzyć kolor pisaka.
Wyjaśnienie
Chromatografia to rodzaj procesu rozdzielania mieszanin. Bibuła filtracyjna jest fazą stacjonarną, a alkohol jest fazą ruchomą, która ciągnie składniki mieszaniny podczas jej przechodzenia przez fazę stacjonarną. W tym procesie im większa interakcja z alkoholem, tym szybciej pigment będzie się poruszał wraz z przejściem rozpuszczalnika.
Składniki materiału, ponieważ mają różne właściwości, będą oddziaływać z fazą ruchomą na różne sposoby, co można zauważyć po różnych czasach przeciągania w fazie stacjonarnej.
Dowiedz się więcej o chromatografia.
2. doświadczenie - konserwacja żywności
Zastosowane pojęcia: związki organiczne i reakcje chemiczne
Materiały
- jabłko, banan lub gruszka
- sok z cytryny lub pomarańczy
- Tabletka z witaminą C
Jak zrobić
- Wybierz jeden z trzech owoców i pokrój go na 3 równe części.
- Pierwszy utwór posłuży jako porównanie z pozostałymi. Więc nic do niego nie dodawaj, po prostu zostaw go na działanie powietrza.
- Na jeden z kawałków wlej zawartość cytryny lub pomarańczy. Rozprowadź tak, aby całe wnętrze owocu zostało pokryte sokiem.
- W ostatniej części rozprowadź witaminę C, może to być zmiażdżona tabletka, na całym miąższu owoców.
- Obserwuj, co się dzieje i porównaj wyniki.
Wynik
Miąższ owoców wystawiony na działanie powietrza powinien szybko ciemnieć. Sok z cytryny lub pomarańczy oraz witamina C, substancja chemiczna zwana kwasem askorbinowym, powinny spowolnić brązowienie owoców.

Wyjaśnienie
Kiedy kroimy owoc, jego komórki ulegają uszkodzeniu, uwalniając enzymy, takie jak oksydaza polifenolowa, która kontakt z powietrzem utlenia związki fenolowe obecne w żywności i powoduje enzymatyczne brązowienie.
Aby zapobiec działaniu tlenu, stosuje się konserwanty, takie jak kwas askorbinowy, ponieważ są one preferencyjnie utleniane zamiast związków fenolowych. Oprócz tabletki witaminy C kwas askorbinowy występuje również w sugerowanych w eksperymencie źródłach naturalnych, takich jak cytrusy, cytryny i pomarańcze.
Dowiedz się więcej o utlenianie.
3. doświadczenie – kto szybciej zamarza?
Zastosowane pojęcia: właściwości koligatywne i krioskopia
Materiały
- dwie tuby (używane do przysług na przyjęcia)
- szklana miska
- sól kuchenna
- filtrowana woda
- lód
- termometr
Jak zrobić
- Dodaj taką samą ilość przefiltrowanej wody do obu probówek. Na przykład 5 ml w każdej probówce.
- Dodaj sól kuchenną do jednej z probówek i przyklej taśmę identyfikacyjną, aby odróżnić, która z nich jest słona.
- Napełnij szklany pojemnik kruszonym lodem i dodaj trochę soli.
- Umieść dwie probówki jednocześnie w lodzie i obserwuj, co się stanie.
- Zapisz temperaturę zamarzania dla każdej sytuacji.
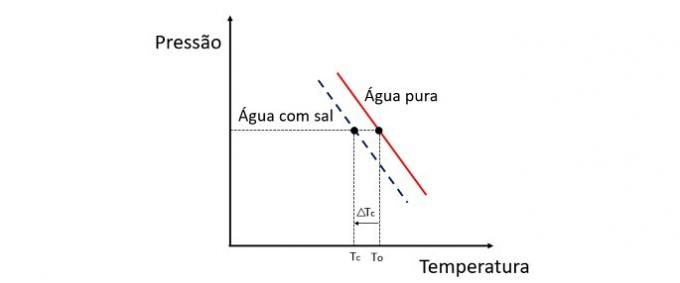
Wynik
Dodanie substancji rozpuszczonej do wody obniża temperaturę zamrażania. Dlatego zwykła woda ma tendencję do zamarzania znacznie szybciej niż roztwór soli i wody w tych samych warunkach.
Wyjaśnienie
Krioskopia jest właściwością koligatywną, która bada zmiany temperatury rozpuszczalnika, gdy rozpuszcza się w nim różne ilości substancji rozpuszczonej.
Obniżenie temperatury zamarzania wody spowodowane jest nielotną substancją rozpuszczoną i zjawisko to ma wiele praktycznych zastosowań. Dlatego większe stężenie substancji rozpuszczonej w roztworze wpływa na efekt krioskopii.
Jeśli np. woda zamarznie w 0 °C i dodamy do niej sól, to temperatura przemiany fazowej będzie ujemna, czyli znacznie niższa.
Dzięki temu woda morska nie zamarza w miejscach o temperaturze poniżej 0°C. Sól rozpuszczona w wodzie ma tendencję do dalszego obniżania temperatury zamarzania. W miejscach, gdzie leży śnieg, często posypuje się drogi solą, aby roztopić lód i uniknąć wypadków.
Dowiedz się więcej o właściwości koligatywne.
4 doświadczenie - rozkład nadtlenku wodoru
zaangażowane koncepcje: reakcja chemiczna i katalizator
Materiały
- Pół surowego ziemniaka i pół ugotowanego
- Kawałek surowej wątroby i kolejny kawałek ugotowany
- Nadtlenek wodoru
- 2 dania
Jak zrobić
- Do każdego dania dodać jedzenie, ziemniaki razem i wątróbki razem.
- W każdym z czterech materiałów dodaj 3 krople nadtlenku wodoru.
- Obserwuj, co się dzieje i porównaj wyniki.
Wynik
Nadtlenek wodoru, roztwór nadtlenku wodoru, w kontakcie z surową żywnością zaczyna musować niemal natychmiast.
Ten eksperyment można również przeprowadzić, dodając kawałek jedzenia do pojemnika z nadtlenkiem wodoru, aby reakcja była bardziej zauważalna.
Wyjaśnienie
W kontakcie z surową żywnością charakterystyczne jest musowanie, jakie daje nadtlenek wodoru wystąpienie reakcji chemicznej, czyli rozkład nadtlenku wodoru i uwolnienie gazu tlen.
Rozkład nadtlenku wodoru następuje poprzez działanie enzymu katalazy, znajdującego się w organellach peroksysomów, obecnego w komórkach zwierzęcych i roślinnych.
Należy zauważyć, że rozkład nadtlenku wodoru zachodzi spontanicznie, w obecności światła słonecznego, ale w bardzo powolnej reakcji. Katalaza działa jednak jak katalizator, zwiększając szybkość reakcji chemicznej.
Nadtlenek wodoru może być substancją toksyczną dla komórek. Dlatego katalaza rozkłada związek i wytwarza wodę i tlen, dwie substancje, które nie szkodzą organizmowi.
Gdy jedzenie jest gotowane, jego składniki ulegają zmianom. Modyfikacje wywołane gotowaniem również osłabiają działanie katalazy poprzez denaturację białka.
To samo działanie, które obserwujemy w przypadku jedzenia, ma miejsce, gdy na ranę nałożymy nadtlenek wodoru. Działa katalaza i następuje tworzenie się bąbelków, co polega na uwolnieniu tlenu.
Dowiedz się więcej o reakcje chemiczne.
Odniesienia bibliograficzne
ŚWIĘCI, W. L. P.; MOL, G. Św. (Współrzędne). Chemia obywatelska. 1. wyd. São Paulo: Nowa generacja, 2011. v. 1, 2, 3.
BRAZYLIJSKIE TOWARZYSTWO CHEMICZNE (org.) 2010. Chemia w pobliżu: Niedrogie eksperymenty w klasie K-12. 1. wyd. San Paulo.