Alkeny lub alkeny to węglowodory, które mają podwójne wiązanie w łańcuchu węglowym.
Ogólny wzór na alkeny to: CNieH2n.
Większość alkenów wytwarzana jest w laboratorium, a niewiele z nich występuje w naturze.
funkcje
Główne cechy alkenów to:
- bezbarwny
- Nierozpuszczalne w wodzie
- Rozpuszczalny w alkoholu i eterze
- Są bardziej reaktywne niż alkany
- Temperatura topnienia i wrzenia jest wyższa niż alkanów o tej samej liczbie atomów węgla
- Najprostszym alkenem jest etylen lub etylen
Dowiedz się również o:
- alkany
- Alkiny
- alkadien
Nomenklatura
Alkeny otrzymują tę samą nomenklaturę, co inne węglowodory.
PREFIKS + INFIX + SUFIKS
Przedrostek wskazuje ilość węgli w głównym łańcuchu.
Wrostek określa termin „en”, który reprezentuje wiązanie podwójne. Przyrostek jest podany przez literę „o”, która wskazuje na związek węglowodorowy.
Dlatego alkeny są nazywane sufiksem – eno, co wskazuje na podwójne wiązanie.
Ponadto należy wskazać pozycję wiązania podwójnego. Liczba ta poprzedza nazwę alkenu i wskazuje atom węgla, od którego zaczyna się wiązanie.
Łańcuch węglowy zaczyna być numerowany od najbliższego końca wiązania podwójnego.
Przykłady
Eten lub etylen: CH2 = CH2
Propylen lub Propylen: CH2 = CH - CH3, którego równoważny wzór jest zapisany następująco: CH3 — CH = CH2
1-buten: CH2 = CH - CH2 – CH3
2-buten: CH3 – CH = CH – CH3
Często występują również alkeny izomeria:
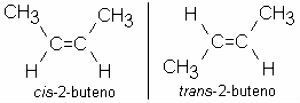
rozgałęzione alkeny
Alkeny mogą być również rozgałęzione. W tym przypadku główny łańcuch jest najdłuższy i ma podwójne wiązanie.
Przykład:
5-metylo-2-heksan
Dowiedz się więcej o Nomenklatura węglowodorów.
Uzupełnij swoje badania na Węglowodory. Przeczytaj też:
- Benzen
- Butan
- Cyklanie
- Ropa naftowa
- Związki organiczne
- Aromatyczne węglowodory
- Ćwiczenia na węglowodorach