Struktura białka odnosi się do jego naturalnej konformacji niezbędnej do pełnienia jego funkcji biologicznych.
Białka to makrocząsteczki utworzone przez połączenie aminokwasów.
Aminokwasy są połączone wiązaniami peptydowymi. Cząsteczki powstałe w wyniku połączenia aminokwasów nazywane są peptydami.
Białka mają cztery poziomy strukturalne: strukturę pierwszorzędową, drugorzędową, trzeciorzędową i czwartorzędową.
Pierwotna struktura białek
Pierwotna struktura odpowiada liniowa sekwencja aminokwasów połączone wiązaniami peptydowymi.
W niektórych białkach zastąpienie jednego aminokwasu innym może spowodować chorobę, a nawet śmierć.
Struktury przestrzenne białek
Struktury przestrzenne białek wynikają z fałdowania i składania na sobie nici białkowej.
Właściwości funkcjonalne białek zależą od ich struktury przestrzennej.
Struktura drugorzędna
Struktura wtórna odpowiada pierwszemu poziomowi uzwojenia śrubowego.
Charakteryzuje się regularnymi i powtarzającymi się wzorami, które występują lokalnie, spowodowane przyciąganiem się między niektórymi pobliskimi atomami aminokwasów.
Dwa najczęstsze układy lokalne, które odpowiadają strukturze drugorzędowej, to alfa-helisa i beta-liść lub beta-sfałdowany.
- konformacja helisy alfa: charakteryzuje się trójwymiarowym układem, w którym łańcuch polipeptydowy przyjmuje konformację spiralną wokół wyimaginowanej osi.
- konformacja arkusza beta: występuje, gdy łańcuch polipeptydowy rozciąga się zygzakiem i może być ułożony obok siebie.
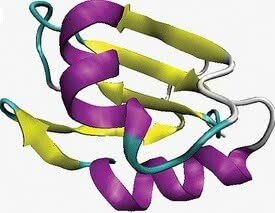
Struktura drugorzędowa. Na fioletowo konformacja alfa-helisy, a na żółto liść beta
Struktura trzeciorzędowa
Struktura trzeciorzędowa odpowiada samemu fałdowaniu łańcucha polipeptydowego.
W strukturze trzeciorzędowej białko przybiera specyficzny trójwymiarowy kształt dzięki globalnemu fałdowaniu całego łańcucha polipeptydowego.
Struktura czwartorzędowa
Podczas gdy wiele białek jest tworzonych przez pojedynczy łańcuch polipeptydowy. Inne składają się z więcej niż jednego łańcucha polipeptydowego.
Struktura czwartorzędowa odpowiada dwóm lub większej liczbie łańcuchów polipeptydowych, identycznych lub nie, z tej grupy i dopasowanych do siebie, tworząc całkowitą strukturę białka.
Na przykład cząsteczka insuliny składa się z dwóch połączonych łańcuchów. Tymczasem hemoglobina składa się z czterech łańcuchów polipeptydowych.
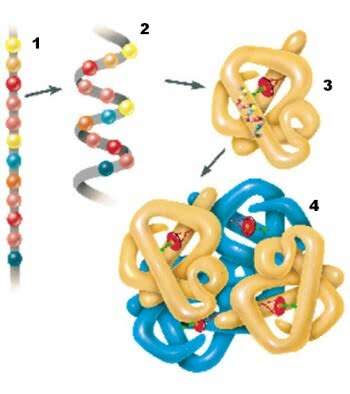
1. Struktura pierwotna; 2. Struktura drugorzędowa; 3. struktura trzeciorzędowa; 4. Struktura czwartorzędowa.
Dowiedz się więcej o Białka.
Denaturacja białka
Aby białka mogły pełnić swoje funkcje biologiczne, muszą wykazywać swoją naturalną konformację.
Ciepło, kwasowość, stężenie soli i inne warunki środowiskowe mogą zmieniać strukturę przestrzenną białek. W rezultacie ich łańcuchy polipeptydowe rozwijają się i tracą naturalną konformację.
Kiedy tak się dzieje, nazywamy to denaturacja białka.
Skutkiem denaturacji jest utrata funkcji biologicznej charakterystycznej dla tego białka.
Jednak sekwencja aminokwasowa nie jest zmieniona. Denaturacja odpowiada jedynie utracie konformacji przestrzennej białek.
Aby dowiedzieć się więcej, przeczytaj również o peptydy i wiązania peptydowe.