Kiedy mówimy słowo „równoważyć”, przychodzi na myśl przedmiot, który pozostaje w nieskończoność. Jest to jednak tylko jeden rodzaj równowagi, zwany "statyczna równowaga".
Jest też „równowaga dynamiczna”. W nim, jak sama nazwa wskazuje, nie ma ani jednego momentu, w którym przedmiot lub zjawisko jest nieruchome. Na przykład, aby zrozumieć, spójrz na poniższą ilustrację i zauważ, że ilość wody, która wpada do pojemnika jest równa ilości, która z niego wypływa, utrzymując stały poziom wody. W takim przypadku mówimy, że istnieje równowaga dynamiczna, równowaga w ruchu.

To taki rodzaj równowagi, który występuje w reakcje odwracalne, to znaczy w tych reakcjach, które zachodzą w obu kierunkach. W tym samym czasie, gdy molekuły reagentów przekształcają się w produkty, molekuły produktów reagują ze sobą tworząc reagenty. Odwracalność reakcji reprezentują strzałki w obu kierunkach:
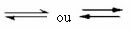
Gdy tempo rozwoju reakcji bezpośredniej (tworzenia produktów) jest równe tempu rozwoju reakcja odwrotna (powstawanie reagentów) w stałej temperaturze oznacza, że reakcja osiągnęła stan równowagi chemiczny.
A w przypadku reakcji z obecnością tylko cząsteczek w substratach i produktach mamy a równowaga molekularna.Poniżej znajduje się przykład reakcji zachodzącej między gazowym wodorem (H2) i jodu gazowego (I2), do tworzenia gazowego jowodorku (HI):
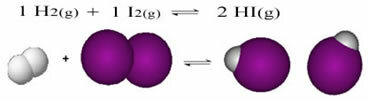
Na początku reakcji tempo rozwoju reakcji bezpośredniej było większe, ostatecznie stężenie reagentów było maksymalne, a produktów zero. Tak więc tempo rozwoju reakcji odwrotnej też było zerowe.
Jednak z biegiem czasu gazy wodorowe i jodowe reagują, wytwarzając produkt. W ten sposób stężenie odczynników zaczyna spadać, a tempo ich rozwoju również spada.
Wraz ze wzrostem stężenia produktów i spadkiem stężenia reagentów, tempo rozwoju reakcji odwrotnej zaczyna wzrastać. Jeśli temperatura będzie utrzymywana na stałym poziomie, nadejdzie czas, kiedy obie szybkości rozwoju pozostaną takie same, pokazując tym samym, że reakcja osiągnęła chemiczną równowagę molekularną.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm


