Niektóre związki mają w swojej strukturze wiązania podwójne na przemian z wiązaniami pojedynczymi. Najsłynniejszym z nich jest benzen, którego budowę zaproponował w 1865 roku niemiecki chemik Friedrich August Kekulé (1829-1896). Jego struktura byłaby cykliczna i składałaby się z trzech wiązań podwójnych przeplatanych trzema wiązaniami pojedynczymi, jak pokazano na poniższych rysunkach:
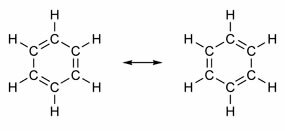
Oba sposoby przedstawiania benzenu są dopuszczalne, ponieważ możliwa jest zmiana elektronów w wiązaniach π bez zmiany położenia atomów. Jednak ani nie reprezentuje dokładnie tego, kim jest, ani nie wyjaśnia swojego zachowania. Powinien zachowywać się jak alken i wywoływać reakcje addycyjne, ale w praktyce tak się nie dzieje. Benzen jest dość stabilny i działa tak, jakby nie miał podwójnych wiązań; daje reakcje podstawienia jak w alkanach.
W 1930 roku amerykański naukowiec Linus Pauling zaproponował teorię rezonansu, która wyjaśnia tę pozorną sprzeczność. Ta teoria mówi:
„Ilekroć we wzorze strukturalnym możemy zmienić położenie elektronów bez zmiany położenia atomów, prawdziwa struktura Nie nie będzie żadną z otrzymanych struktur, ale raczej hybryda rezonansowa tych struktur.”
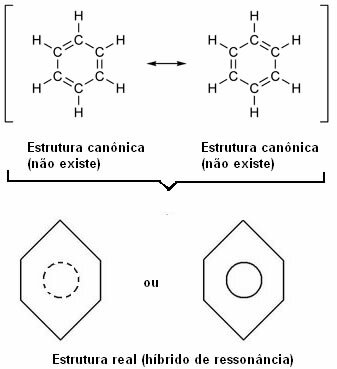
O tym efekcie świadczy wielkość wiązań węglowych i odległość między nimi. Ta odległość jest pośrednia w stosunku do wiązania pojedynczego (1,54 Å) i wiązania podwójnego (1,34 Å); będąc zatem 1,39 Å, ze względu na efekt rezonansu.
Efekt ten można również zaobserwować w strukturze cząsteczki ozonu (O3), jak pokazano niżej:
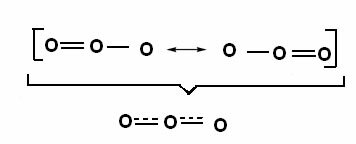
Struktury kanoniczne i hybrydy rezonansu ozonowego.
Jennifer Fogaça
Absolwent chemii
Brazylijski zespół szkolny.
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm