ty Węglowodory składają się z węgiel (C) i wodór (H). Elastyczność węgla, który jest głównym pierwiastkiem tych związków, sprzyja istnieniu ogromnej różnorodności struktur Dlatego niektóre właściwości, takie jak temperatura topnienia i temperatura wrzenia, mogą się różnić w zależności od węglowodoru.
Są to głównie molekuły apolarny, z siłas międzycząsteczkowy indukowany typ dipola i gęstość mniejsza niż z wody. Identyfikację tych związków można przeprowadzić za pomocą nomenklatury, która jest zgodna z zasadami ustanowionymi przez Międzynarodową Unię Chemii Czystej i Stosowanej (Iupac).
Przeczytaj też: Węgiel - jeden z najobficiej występujących pierwiastków we Wszechświecie
Właściwości węglowodorów

Biegunowość: węglowodory bez obecności heteroatomów są apolarny.
Siły międzycząsteczkowe: wiązania między cząsteczkami węglowodoru są typu indukowany dipol.
temperatura topnienia i iwrzenie: różnią się w zależności od wielkości, funkcji i organizacji strukturalnej cząsteczki.
stan fizyczny: w normalnych warunkach temperatury i ciśnienia węglowodory zawierające cztery lub mniej atomów węgla są w stanie gazowym. Te zawierające od 5 do 17 atomów węgla są w stanie ciekłym, a węglowodory zawierające więcej niż 17 atomów węgla są substancjami stałymi.
Gęstość: jest mniejszy niż gęstość wody, tj. mniej niż 1,0 g/cm3.
Reaktywność: węglowodory alifatyczne i nienasycone są słabo reaktywne; związki nienasycone częściej reagują z innymi cząsteczkami, a węglowodory cykliczne zawierające do pięciu atomów węgla są bardzo reaktywne.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Klasyfikacja węglowodorów
Węglowodory można sklasyfikować według organizacji strukturalnej łańcucha i przez zakłady.Nienasycenie to obecność podwójnego(-ych) lub potrójnego wiązania między węglami, czy występowanie połączenia typu pi (π). już gałęzie są jak „gałęzie” przymocowane do większej struktury węglowodorowej. Łańcuchy cykliczne mogą również zawierać rozgałęzienia i/lub nienasycenia – struktura strukturalna węglowodorów o zamkniętym łańcuchu tworzy wielokąty, takie jak m.in. kwadrat, trójkąt, heksan.
Jeśli chodzi o układ atomów, węglowodór może mieć łańcuch normalny lub rozgałęziony.
→ Węglowodór Clinia normalna, liniowa lub prosta: ten ze sznurkiem, który ma tylko dwa końce.

→ Węglowodór Cnienawidzi rozgałęziony: ten z łańcuszkiem, który ma więcej niż dwa końce. Aby wiedzieć, gdzie i jakie są gałęzie, ważne jest, aby prawidłowo wybrać główny łańcuch. Główny łańcuch musi zawierać wszystkie nienasycenia i heteroatomy (jeśli występują), jak również największa liczba węgli sekwencyjnych. Węgle, które nie są zawarte w głównym łańcuchu, to gałęzie.
Przykład:

W odniesieniu do „zamknięcia” węglowodór może mieć łańcuch zamknięty, otwarty lub mieszany.
→ Węglowodory łańcuchowes zamknięte lub cykliczne: te z łańcuchami, w których atomy organizują się, tworząc cykl, wielokąt lub pierścień aromatyczny (zamknięty węglowodór z naprzemiennymi nienasyceniami). Nie miej luźnych końców, chyba że jest gałąź. Każdy wierzchołek wielokąta reprezentuje węgiel i odpowiadające mu środki wiążące wodór.
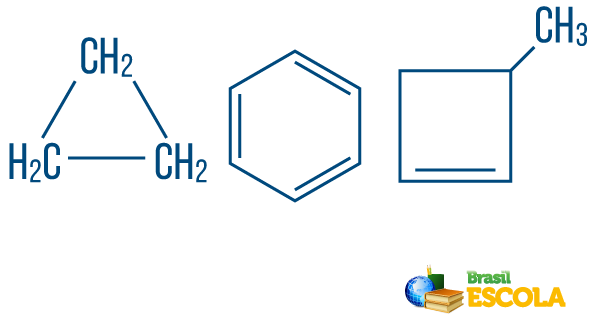
→ Węglowodory o otwartym łańcuchu lub acykliczne: to te z łańcuchami, które mają co najmniej dwa końce.

→ Węglowodór z mieszany ciąg znaków: jest utworzony przez pierścień lub łańcuch cykliczny dołączony do części liniowej; ma co najmniej jeden koniec.
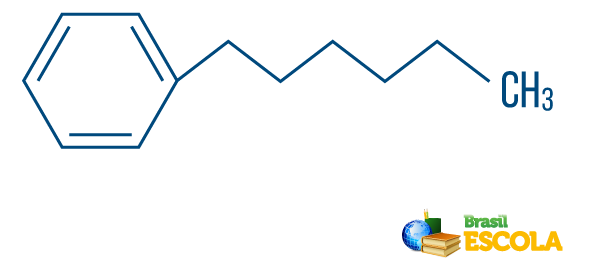
Przeczytaj też: Węglowodory aromatyczne - przykłady i właściwości
Nomenklatura węglowodorów
Dla każdego rodzaju węglowodoru istnieje zasada nazewnictwa ustanowiona przez Iupac. Nomenklatura tych związków jest następująca:
I część: lokalizacja i nazwa oddziału(ów) (jeśli istnieje);
Druga część: termin ma zastosowanie cykl jeśli związek jest łańcuchem zamkniętym, ale jeśli jest to łańcuch alifatyczny (otwarty), nie jest to konieczne;
3. część: prefiks wskazujący, ile węgli znajduje się w głównym łańcuchu;
Czwarta część: lokalizacja i wrostek wskazujący na rodzaj nienasycenia w cząsteczce;
5. część: przyrostek „o” właściwy dla węglowodorów.
Jeśli cząsteczka ma strukturę otwartą, bez rozgałęzień, nazewnictwo rozpocznie się w części 3.
Poniższa tabela przedstawia wymagane informacje (przedrostek, infiks i sufiks) dla ogólnej nomenklatury węglowodorów. O prefiks zmienia się w zależności od liczby węgli; O infiks, według liczby nienasyceń; to jest przyrostek“O" odnosi się do związków typu węglowodorów.
Prefiks |
Infiks |
Przyrostek |
||
1 węgiel |
spotkał- |
Tylko pojedyncze połączenia |
-na- |
-O |
2 węgle |
et- |
|||
3 węgle |
rekwizyt- |
1 podwójne wiązanie |
-pl- |
|
4 węgle |
ale- |
|||
5 węgli |
zamknięty- |
2 podwójne wiązania |
-dien- |
|
6 węgli |
klątwa- |
|||
7 węgli |
hept- |
1 potrójne wiązanie |
-w- |
|
8 węgli |
październik- |
|||
9 węgli |
nie- |
2 potrójne ogniwa |
-diin- |
|
10 węgli |
grudzień- |
Pierwszym krokiem do odkrycia nomenklatury związku organicznego jest zidentyfikować główny łańcuch węgli, które muszą zawierać nienasycenia i jak najwięcej węgli sekwencyjnych. Po zidentyfikowaniu głównego łańcucha, węgle muszą być policzone – liczenie od strony najbliższej gałęziom i nienasyceniom (jeśli występują). TEN Lokalizacja będzie liczbą węgla, w którym znajduje się gałąź lub nienasycenie. Czasami istnieje tylko jedna możliwa lokalizacja dla wiązania rodnikowego lub podwójnego lub potrójnego, więc nie jest konieczne wyrażanie lokalizacji węgla łączącego w nomenklaturze.

TEN nomenklatura oddziałów zostanie podana przez liczbę węgli w każdym, plus terminację linia lub ll. Gdy istnieje więcej niż jedna gałąź, stosowana jest kolejność alfabetyczna.
Zobacz przykłady poniżej:
→ Przykład 1
CH3 – CH2 – CH3 → Propan
I część: przedrostek „rekwizyt-” wskazuje, że łańcuch ma trzy węgle.
2. część: wrostek "-na-„sygnalizuje, że cząsteczka tworzy tylko połączenia typu” sigma lub proste.
Trzecia część: przyrostek „-O” jest charakterystyczny dla węglowodorów.
→ Przykład 2
CH2=CH-CH2-CH3 → But-1-en
W węglowodorach z nienasyceniem konieczne jest ponumerowanie i zlokalizowanie węgla, w którym występuje para, a numeracja musi być jak najmniejsza. W tym celu zliczanie węgla musi zaczynać się od strony najbliższej wiązaniu podwójnemu.
I część: "ale-" wskazuje, że w łańcuchu znajdują się cztery węgle.
II część: "1-pl" odnosi się do nienasycenia zlokalizowanego między węglem 1 i 2.
III część: "-O" to charakterystyczny przyrostek węglowodorów.
→ Przykład 3

I część: „3-etyl” sygnalizuje, że na węglu 2 istnieje dwuwęglowa gałąź.
II część: "-zamknięty-" wskazuje na obecność pięciu węgli w głównym łańcuchu.
III część: "-na-" jest wrostkiem stosowanym do nienasyconych łańcuchów (bez podwójnych lub potrójnych wiązań).
Czwarta część: "-O" to charakterystyczny przyrostek węglowodorów.
→ Przykład 4
Do łańcuchów z więcej niż jeden oddział, umieść radykały w nomenklaturze w kolejności alfabetycznej. Jeśli w tej samej cząsteczce występują rozgałęzienia i nienasycenia, należy zliczyć atomy węgla w łańcuchu głównym w taki sposób, aby suma cyfr położenia była jak najmniejsza.
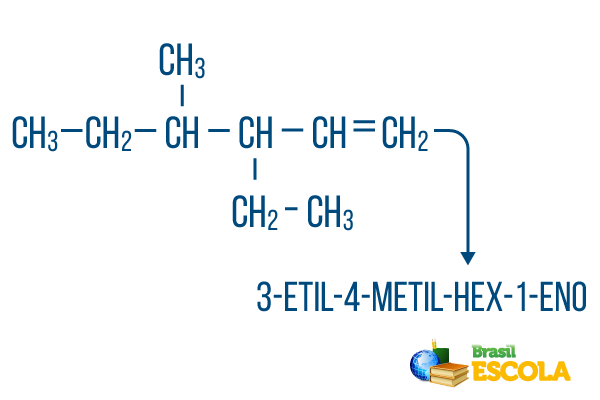
Zliczanie węgla w łańcuchu głównym wykonano od lewej do prawej, a suma liczb nienasycenia i lokalizacji gałęzi wynosi: 1+4+3 = 8. Gdyby liczba węgla była od prawej do lewej, nomenklatura związków byłaby 4-etylo-3-metylo-5-en, którego suma lokalizacji byłaby: 4+3+5 = 12, czyli większa od drugiej hipotezy, więc nie należy jej stosować.
I część: 3-etylo-4-metylo odwołuje się do radykałów w porządku alfabetycznym i ich lokalizacji.
II część: klątwa- oznacza, że w głównym łańcuchu jest 6 atomów węgla.
III część: 1-en wskazuje na obecność podwójnego wiązania na węglu 1.
Czwarta część: "-O" to charakterystyczny przyrostek węglowodorów.
→ Przykład 5
W przypadku ciągów zamkniętych obowiązują zasady nazewnictwa, ale słowo cykl rozpoczyna nazwę związku, wskazując, że jest to węglowodór zamknięty lub cykliczny.
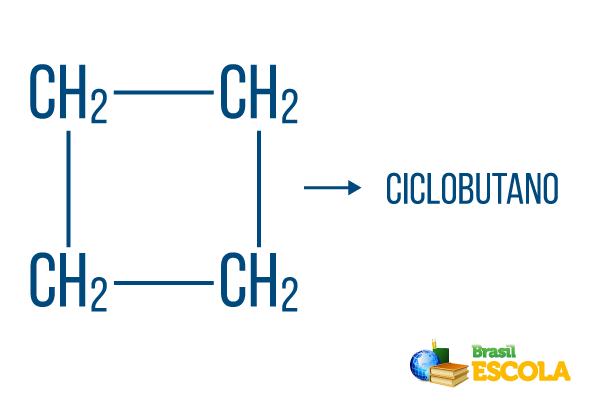
I część: cykl- wskazuje, że jest to zamknięty ciąg.
II część: -ale- oznacza istnienie 4 węgli w łańcuchu
III część: -Oto charakterystyczny przyrostek węglowodorów.
Przeczytaj też: Klasyfikacja łańcuchów węglowych
Rodzaje węglowodorów
Węglowodory można podzielić na alkany, alkeny, alkiny i alkadieny – które są klasyfikowane jako zgodnie z ustanowieniem łańcucha (podwójne(a) lub potrójne wiązania) - i cyklany, które są łańcuchami Zamknięte.
→ Alkany: to węglowodory, które nie mają nienasycenia. Ogólny wzór na alkany to CNieH2n+2, a Nieomenklatura składa się z prefiks + na + O.
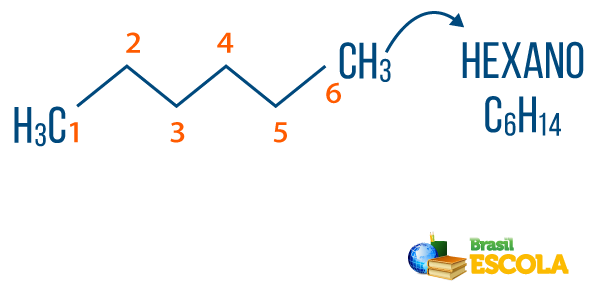
ty alkany można znaleźć w naturzejak gaz metan (CH4), który jest uwalniany przez zwierzęta i wytwarzany w procesach rozkładu, a także w rafineriach i przemyśle petrochemicznym. Związki takie jak propan (DO3H7), butan (DO4H10), który stanowi nasz gaz do gotowania (LPG), a oktan (DO8H18), obecne w paliwie samochodowym, są produktami ubocznymi Ropa naftowa.

→ alkeny lub alkeny: to łańcuchy węglowe, które mają nienasycenie, podwójne wiązanie. Jego ogólna formuła to CNieH2n, i Twoje Nieomenklatura składa się z Prefix + pl + o.

O gaz etylenowy (DO2H4), stosowany w rolnictwie w celu przyspieszenia dojrzewania owoców, należy do funkcji alken. Mieszanka wykorzystywana jest również w produkcji surowca polietylen, stosowany w produkcji przyborów z tworzyw sztucznych.
→ Alkiny lub acetylenowy: węglowodory z potrójnym wiązaniem. Jego ogólna formuła to CNieH2n - 2. TEN nomenklatura składa się z przedrostek + w + o.

O acetylen lub etyna (C2H2) jest gazem o funkcji alkinowej stosowanym w spawy i cięcia metali,. Związek ten może osiągać temperatury do 3000 °C, co pozwala na przeprowadzanie napraw zanurzonych części statku.

→ alkadieny lub dieny: łańcuchy węglowe z dwoma nienasyceniami, czyli dwoma podwójnymi wiązaniami między węglami. Ogólna formuła tej funkcji to C.NieH2n - 2. Zdaj sobie sprawę, że to ta sama formuła co alkiny, co oznacza, że może się zdarzyć izomeria między związkami (ten sam wzór cząsteczkowy dla różnych związków).
Nomenklatura alkadienu składa się z Prefix + die + o.
Przykład:

→ Węglowodory o zamkniętym łańcuchu: cząsteczki organizują się w sposób cykliczny, mają tendencję do tworzenia wielokątów i, tak jak w łańcuchach otwartych, mogą wystąpić ustanawiania i/lub rozgałęzienia. Cyklony, cykleny, cykliny i benzeny to węglowodory o zamkniętym łańcuchu.
Cyklony lub cykloalkany: łańcuchy cykliczne składające się tylko z pojedynczych wiązań. Jego ogólna formuła to CNieH2n. Nomenklatura: ciclo + prefiks + an + o.
Cykle lub cykloalkeny: zamknięte łańcuchy węglowodorowe z zakładem. Jego ogólna formuła to CNieH2n-2. Nomenklatura: doiclo + prefiks + en + O.
-
Cykliny lub cykloalkiny: węglowodory o zamkniętym łańcuchu z obecnością dwóch wiązań podwójnych. Jego ogólna formuła to CNieH2n-4. Nomenklatura: doiclo + prefiks + in + o.
benzeny
Benzen jest rodzajem węglowodoru o zamkniętym łańcuchu z sześć węgli gdzie wiązania różnią się między pojedynczymi i podwójnymi. Te związki są toksyczny i wysoce rakotwórcze, stosowane jako rozpuszczalniki organiczne w procesach chemicznych.
Aby węglowodór można było uznać za aromatyczny, musi istnieć co najmniej jeden pierścień benzenowy, który jest wysoce reaktywny, dlatego podlega dwóm lub więcej części zamienne, które tutaj zobaczymy jako rozgałęzienia. Kiedy istnieją dwa łączące radykały, będziemy mieć określone nazwy dla każdej pary pozycji.
Radials na 1,2 węglach benzenu → orto
Rodniki przy węglu 1,3 benzenu → cel
Radials na węglu1,4 benzenu → dla
Annomenklaturę związku aromatycznego wykonuje się w następujący sposób:
I część: pozycjonowanie ligandów (orto, cel lub do).
Druga część: nazwa rodnika lub rodników przyłączonych do benzenu (metyl, etyl, propyl…). Nazwa nadana rodnikom wynika z zasady innych węglowodorów.
- III część: -bzatruć, co jest terminem charakterystycznym dla węglowodorów aromatycznych.
Przykłady:
→ Orto-dimetylo-benzen

I część: Ordo- wskazuje, że rodniki są umieszczone na węglach 1 i 2.
II część: -etan- odnosi się do dwóch rodników, obydwa z jednym węglem.
III część: -benzen jest określeniem charakterystycznym dla węglowodorów aromatycznych.
→ Orto-etylo-metylo-benzen
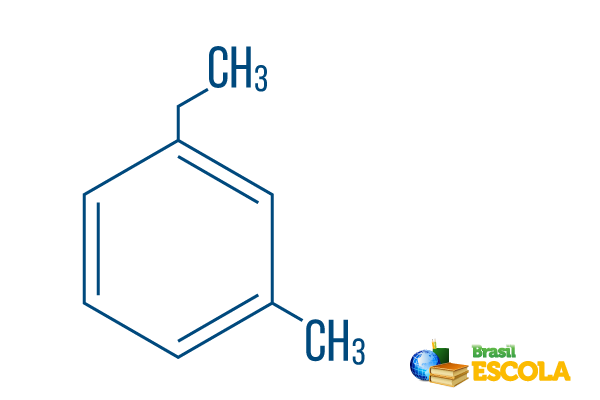
I część: mO- wskazuje, że rodniki są umieszczone na węglach 1 i 3.
II część: etylo-metylo- odnosi się do ilości węgla w każdym rodniku, będąc etyl gałąź dwuwęglowa i metyl rozgałęzienie jednym węglem - umieszczone w nomenklaturze w kolejności alfabetycznej.
III część: -benzen jest określeniem charakterystycznym dla węglowodorów aromatycznych.
→ Para-dietylobenzenbenzen
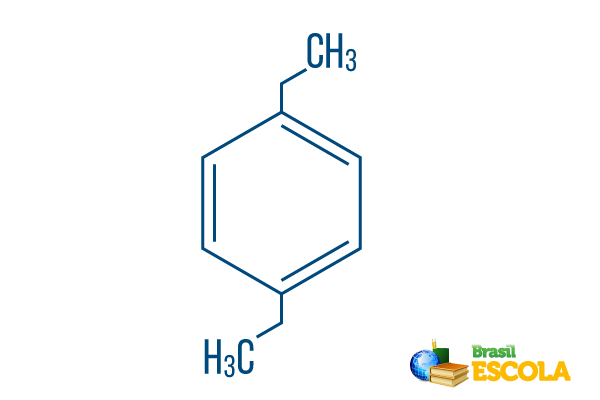
I część: Ppług- wskazuje, że rodniki znajdują się na węglach 1 i 4 benzenu.
II część: -dietylo- nawiązuje do dwóch rodników tego typu etyl, to znaczy dwie gałęzie z dwoma węglami każda.
III część: -benzen jest określeniem charakterystycznym dla węglowodorów aromatycznych.
Przeczytaj też:Odkrycie struktury benzenu
Ćwiczenia rozwiązane
(Niespój) – Oktan jest jednym z głównych składników benzyny, która jest mieszaniną węglowodorów. Wzór cząsteczkowy oktanu to:
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Odpowiedź: litera a). Analiza nomenklatury złożonej oktan, jest to alkan, czyli cząsteczka składająca się tylko z pojedynczych wiązań. Jeśli ogólny wzór na alkany to CNieH2n+2, zastępując „n” ośmioma, co oznacza ilość węgli w głównym łańcuchu – i unikalną w tym przypadku – będziemy mieli, że wzór cząsteczkowy oktanu to C8H18.
(UFSCar-SP) – Rozważ następujące stwierdzenia dotyczące węglowodorów.
I) Węglowodory to związki organiczne składające się wyłącznie z węgla i wodoru.
II) Tylko prostołańcuchowe nienasycone węglowodory nazywane są alkenami.
III) Cykloalkany to nasycone węglowodory alifatyczne o wzorze ogólnym CnH2n.
IV) Czy węglowodory aromatyczne: bromobenzen, p-nitrotoluen i naftalen.
Poprawne są następujące stwierdzenia:
a) tylko I i III.
b) tylko I, III i IV.
c) tylko II i III.
d) tylko III i IV.
e) tylko I, II i IV.
Odpowiedź: litera a).
II – Alkeny to związki z podwójnym wiązaniem, czyli nienasycone, ale mogą mieć w swoim łańcuchu rozgałęzienia, nie będące wyłącznie liniowymi.
IV - Związki brometobenzenu i p-nitrotoluenu należą do innych funkcje organiczne.
przez Laysę Bernardes
Nauczyciel chemii

