Francuski chemik Joseph Louis Proust (1754-1826) przystąpił do przeprowadzania dokładnych eksperymentów dotyczących mas składników niektórych reakcji.
Na przykład pierwiastki tworzące wodę to wodór i tlen. Proust odkrył, że w tej reakcji tworzenia wody wodór zawsze reagował z tlenem w stałym i określonym stosunku, który wynosił odpowiednio 1:8. Zobacz, jak to się dzieje poniżej:

Zauważ, że bez względu na masę użytych elementów, proporcje zawsze będą takie same.
Proust zauważył, że dotyczy to nie tylko wody, ale wszystkich innych substancji.
15,06 g siarczku miedzi (CuS) powstaje, na przykład, w reakcji 10,00 g metalicznej miedzi (Cu) z 5,06 g siarki (S). Tak więc, jeśli podwoimy ilość miedzi (która wzrośnie do 20,0 g) i jeśli chcemy, aby cała miedź przereagowała, konieczne będzie również podwojenie ilości siarki do 10,12 g, przy całkowitym utworzeniu 30,12 g siarczek.
Teraz, jeśli zostanie dodana ilość, która nie jest proporcjonalna, nadwyżka pozostanie, nie zareaguje. Zwróć uwagę na to poniżej:
Teraz nie przestawaj... Po reklamie jest więcej ;)
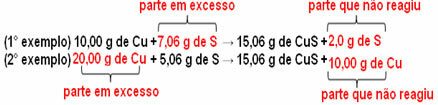
Zauważ, że reakcja zachodzi tylko w określonej proporcji. Dlatego w 1799 Proust doszedł do wniosku, że: gdy kilka substancji łączy się, tworząc związek, zawsze odbywa się to w określonej relacji masy.
Stworzył więc Prawo, które nazywa się Prawo Prousta, Prawo stałych proporcji lub Prawo określonych proporcji, który jest określony w następujący sposób:

To prawo i Prawo Lavoisiera (Prawo ochrony masowej) są nazywane Przepisy dotyczące wagi, ponieważ przemawiają w masach zaangażowanych substancji.
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Prawo Prousta lub prawo stałych proporcji”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Dostęp 27 czerwca 2021 r.