Dla klasyfikować link sigma, ważne jest, aby wiedzieć, jak rozpoznać go w strukturze cząsteczki. Wiązanie sigma jest w rzeczywistości wiązaniem kowalencyjnym, które występuje, gdy dwa niekompletne orbitale atomowe (z tylko jednym elektronem) przenikają się na tej samej osi. Przykładem jest sytuacja, w której orbital typu p (helisa) przenika się z innym orbitalem p.

p orbitale przenikające się w wiązaniu p-p sigma
W praktyce (w ćwiczeniach), rozpoznanie i klasyfikacja połączenia sigma odbywa się ze wzoru strukturalnego substancji, jak w poniższej reprezentacji strukturalnej:

Wzór strukturalny kwasu cyjanowodorowego
Przed sklasyfikowaniem linku sigma, trzeba wiedzieć, jak to rozpoznać we wzorze strukturalnym. W tym celu po prostu pamiętaj sposoby jak a wiązanie kowalencyjne jest reprezentowany: telefon prosty jest reprezentowana przez pojedynczy myślnik (-), para jest reprezentowany przez dwa (=) i link potroić jest reprezentowana przez trzy (≡). Wiązanie sigma występuje w dowolnej z trzech reprezentacji wiązań kowalencyjnych w następujący sposób:
Prosty: ma wiązanie sigma;
Para: Z tych dwóch łączy tylko jedno to sigma;
Potroić: Jednym z trzech ogniw jest sigma.
Wiedząc, jak rozpoznać link sigma, następnym krokiem jest nauczenie się, jak go pozycjonować. W tym celu musimy wiedzieć, jaki jest niepełny orbital każdego atomu zaangażowanego w wiązanie:
H - przedstawia niepełny orbital s, zatem w klasyfikacji jest reprezentowany przez s.
Ametale- mają niekompletny orbital p, a zatem w klasyfikacji są reprezentowane przez p, z wyjątkiem następujących elementów:
Węgiel: Twój niekompletny orbital zależy od rodzaju hybrydyzacja że cierpi. Możliwości to: hybrydyzacja sp3 (ile kosztuje cztery proste połączenia), sp2 (ile to daje dwa wiązania pojedyncze i jedno podwójne) lub sp (ile wykonuje dwa podwójne wiązania lub jedno pojedyncze i jedno potrójne). Zatem w klasyfikacji wiązania sigma węgiel może być reprezentowany przez sp3, sp2 lub sp w zależności od wykonywanego połączenia.
Beryl:ponieść hybrydyzacja typu sp, zatem w klasyfikacji jest reprezentowana przez sp.
Bor:ponieść hybrydyzacja typu sp2, zatem w klasyfikacji jest reprezentowana przez sp. z o.o.2.
Mając wszystkie te informacje, najłatwiej jest sklasyfikować łącza sigma obecne w strukturze. Zobaczmy kilka przykładów:
Przykład 1: połączenia sigma w wodzie

Wzór strukturalny wody
Teraz nie przestawaj... Po reklamie jest więcej ;)
Z powyższego wzoru strukturalnego wynika, że woda ma dwie obligacje sigma (dwa proste), będąc nimi między tlenem (reprezentowana przez p) to jest Wodór (reprezentowana przez s). W ten sposób mamy dwa łącza sigma podzielone na:
s-p
Przykład 2: Wiązania Sigma w trójchlorku fosforu

Wzór strukturalny trójchlorku fosforu
Z powyższego wzoru strukturalnego wynika, że trójchlorek fosforu ma trzy rozmowysigma (trzy proste), będąc nimi wejdź do Fosforu (reprezentowana przez p) to jest chlor (reprezentowana przez p). W ten sposób mamy trzy linki sigma podzielone na:
p-p
Przykład 3: wiązania sigma w trifluorku boru
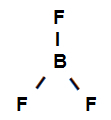
Wzór strukturalny trifluorku boru
Z powyższego wzoru strukturalnego wynika, że trifluorek boru ma trzy linki sigma (trzy proste), będąc nimi wprowadź bor (reprezentowana przez sp2) to jest Fluor (reprezentowana przez p). W ten sposób mamy trzy linki sigma podzielone na:
p-sp2
Przykład 4: wiązania sigma w etanolu
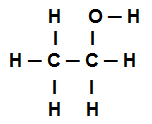
Wzór strukturalny etanolu
Powyższy wzór strukturalny etanolu pokazuje, że mamy obecność ośmiu połączeń sigma (osiem prostych linków). Czy oni są:
Jeden wśród tlenu (reprezentowane przez p) i wodór (reprezentowana przez s). W ten sposób łącze jest klasyfikowane jako sigma s-p.
Jeden z dwóch węgli które wykonują tylko połączenia sigma (a następnie reprezentowana przez sp3). W ten sposób link jest klasyfikowany jako sp3-P3.
Jeden wśród węgla (reprezentowana przez sp3) i tlen (reprezentowana przez p). Tak więc link sigma jest klasyfikowany jako p-sp3.
pięć między węglem (reprezentowana przez sp3) i wodór (reprezentowana przez s). Tak więc wszystkie pięć są klasyfikowane jako s-sp3.
Przykład 5: Wiązania Sigma w dichloroetenu

Wzór strukturalny dichloroetenu
Powyższy wzór strukturalny Dichloroetenu pokazuje, że mamy obecność pięć linków sigma (cztery wiązania pojedyncze i jedno z wiązań podwójnych). Czy oni są:
Jeden z dwóch węgli które wykonują dwa pojedyncze i jedno podwójne wiązania (a następnie reprezentowana przez sp2). Tak więc link sigma jest klasyfikowany jako sp2-P2.
Cztery są między węglem(reprezentowana przez sp2)i wodór (reprezentowana przez s). W ten sposób wszystkie cztery są podzielone na s-sp2.
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Klasyfikacja łącza sigma”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm. Dostęp 28 czerwca 2021 r.



