Hybrydyzacja węgla typu sp2 występuje, gdy ma wiązanie podwójne i dwa wiązania pojedyncze lub wiązanie pi (π) i trzy wiązania sigma (σ). W rzeczywistości hybrydyzacja sp2 powstaje między atomami tworzącymi wiązanie podwójne.
Przykładem takiej cząsteczki jest formaldehyd (CH2O). Zwróć uwagę na jego strukturę poniżej:
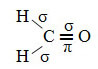
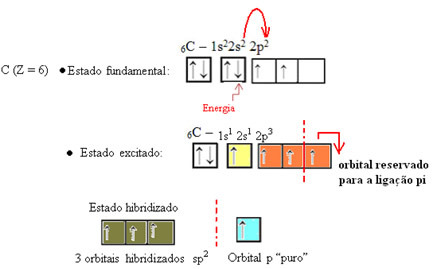
Jak widać w tekście ”hybrydyzacja typu sp3”, hybrydyzacja węglowa zachodzi, gdy elektron z podpoziomu 2s otrzymuje energię i jest „transportowany” do podpoziom 2p, a zatem pochodzą 4 zhybrydyzowane orbitale z „mieszanki” orbitali atomowych czysty.
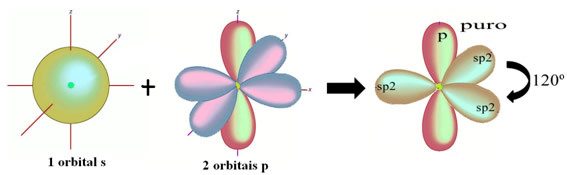
W przypadku formaldehydu wiemy, że będzie wiązanie pi, więc jeden z tych zhybrydyzowanych orbitali jest zarezerwowany dla tego wiązania, podczas gdy pozostałe trzy tworzą wiązania sigma:
Teraz nie przestawaj... Po reklamie jest więcej ;)
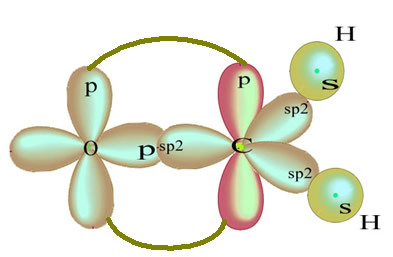
Atomy wodoru, które tworzą pojedyncze wiązanie z węglem, tworzą je ze swoim orbitalem:
Pozostały „czysty” orbital p wiąże się podwójnie z atomem tlenu, a cząsteczka formaldehydu ma następującą strukturę:
Jeśli chodzi o rodzaj wiązań występujących w tej strukturze formaldehydu to mamy:

Znajomości: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Hybrydyzacja typu Sp2”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm. Dostęp 28 czerwca 2021 r.



