Metale to elementy charakteryzujące się jasnością, wytrzymałością, przewodnością cieplną i elektryczną. Oni są zastosowanie praktycznie we wszystkich procesach przemysłowych, obecność w stopach metali stosowanych do produkcji narzędzi, biżuterii i monet oraz w procesach chemicznych, takich jak redox, odpowiedzialnych za działanie półki na książki i baterie.
W układzie okresowym są one podzielone na:
półmetale
metale przejściowe
metale alkaliczne
metale ziem alkalicznych
W przemyśle stalowym dzieli się je na:
metale żelazne
metale nieżelazne
metale ciężkie
Przeczytaj też: Jakie są nowe elementy układu okresowego pierwiastków?
Charakterystyka metalu

Są to w większości doskonałe przewodniki ciepła i energii elektrycznej.
Mają błyszczący wygląd.
mieć wysoki gęstość.
Są pierwiastkami elektrododatnimi (mają tendencję do tworzenia kationów — ładunków dodatnich).
Z wyjątkiem Rtęć, są to pierwiastki o wysokiej temperaturze topnienia i stałe w temperaturze pokojowej.
Posiadają wytrzymałość mechaniczną (wytrzymałość).
Są plastyczne (można je formować bez pękania).
Teraz nie przestawaj... Po reklamie jest więcej ;)
Metale w układzie okresowym pierwiastków
metale alkaliczne
Czy elementy pierwsza kolumna układu okresowego, rodzina 1A. Nazywane są metalami alkalicznymi, ponieważ po zmieszaniu z wodą tworzą wodorotlenki, czyli roztwór zasadowy (zasadowy).
ty elementy należące do tej grupy to:
Lit (li)
Sód (W)
Potas (K)
Rubid (Rb)
Cez (Cs)
Frank (Fr)
Elektroniczna konfiguracja metali alkalicznych występuje tylko w stanie neutralnym (nienaładowanym/zjonizowanym) elektron w ostatniej powłoce (warstwa walencyjna). O promień atomowy a reaktywność tych metali wzrasta od góry do dołu (obserwując Układ okresowy). Mają niską temperaturę topnienia w porównaniu z innymi metalami, są plastyczne i niezbyt gęste, mają matowy wygląd ze względu na wysoki potencjał utleniający.
Zobacz też:Jakie są właściwości materii?
metale ziem alkalicznych
Są to elementy, które pojawiają się w druga kolumna układu okresowego, rodzina 2A. są nazywane ziemia alkaliczna tendencją do tworzenia roztworów o charakterze zasadowym (alkalicznym) i ziemistych, ponieważ przed XIX wiekiem tlenki utworzone przez te substancje były w ten sposób oznaczane. Termin ten został użyty do oznaczenia nierozpuszczalnych metali, które nie uległy mutacji po podgrzaniu, wspólnych cech pierwiastków grupy 2. Później, w świetle nowych badań i eksperymentów, odkryto, że pierwiastki „ziemi” były w rzeczywistości tlenkami utworzonymi przez metale.
Są to metale ciągliwe, o niskiej gęstości, mają dwa elektrony w zewnętrznej powłoce, znajdują się w normalnych warunkach temperatury i ciśnienia w stanie stałym. Do tej grupy należą:
Beryl (Być)
Magnez (Mg)
Wapń (Tutaj)
Stront (Pan)
Bar (ba)
Radio (Żaba)
metale przejściowe
uzupełnić grupa B układu okresowego pierwiastków, i znajdują się pomiędzy metalami ziem alkalicznych a ametale. Zostały one zdefiniowane przez IUPAC jako elementy, które mają niekompletną podwarstwę energetyczną energéticad. Termin "metale przejściowe" odnosi się do przejście z grupy 2 do 13 w układzie okresowym oraz zwiększający się dodatek elektronów na orbicie „d”.
Grupa metali przejściowych składa się z gęstych pierwiastków o wysokich temperaturach topnienia i wrzenia oraz, mniej reaktywne niż metale z grupy 1 i 2 (Rodziny 1A i 2A). Wśród metali przejściowych znajdują się wolfram, który jest pierwiastkiem o najwyższej temperaturze topnienia (3422°C) oraz rtęć (Hg), która jest metalem płynnym w normalnych warunkach temperatury i ciśnienia, jego temperatura topnienia wynosi (-38,83 °C).
Metale przejściowe mają różne stopnie utlenienia (NOX zmienna) i tworzą barwne substancje.

Wewnętrzne elementy przejściowe
Wewnętrzne elementy przejściowe oni są:
Lantanowce: serie składające się z pierwiastków, które mają od 57 do 71 protonów i które z wyjątkiem prometu są naturalne.
Aktynowce: grupa składająca się z pierwiastków o liczbie atomowej od 89 do 103, które w większości są syntetyczne. Cała ta grupa jest radioaktywny z krótkim okresem półtrwania.
Pierwiastki z tych dwóch grup mają wysoką temperaturę topnienia i wszystkie są stałe w temperaturze pokojowej.
Półmetale
ty półmetale jest w sumie siedem elementów:
Bor (B)
Krzem (Si)
German (Ge)
Arsen (as)
Antymon (pon.)
Tellur (Te)
Polon (Po)
Ta klasyfikacja jest nadawana elementom, które mają właściwości fizykochemiczne dotyczące metali, a także inne istotne dla pierwiastków niemetalicznych. Półmetale mają połysk, są związkami kruchymi, zdolnymi do tworzenia zarówno kationów, jak i anionów (w zależności od stanu) i są przewodnikami pośrednimi.
Rodzaje metali
Żelazawy: substancje zawierające w swoim składzie żelazo. Oni są Stopy metali które zawierają żelazo jako wspólny pierwiastek, ale mogą być formułowane z różnymi stężeniami węgiel, na przykład lub kute różnymi technikami, dzięki czemu mają produkty o różnych właściwościach fizycznych.
Metale nieżelazne: stopy utworzone przez inne rodzaje metali, takie jak aluminium, miedź, nikiel, cynk, tytan.
Metale ciężkie: ołów, nikiel, cynk, rtęć. Są metalami reaktywnymi, toksycznymi i bioakumulacyjnymi. Wykorzystywane są m.in. w bateriach, lampach, amunicji do artefaktów wojskowych.
Wiązania chemiczne metali
Metale są elementy elektrododatni, to znaczy mają tendencję do utraty elektronów w wiązaniu chemicznym. Kiedy metal wchodzi w interakcję z niemetalem, to wykonać wiązanie jonowe ze względu na różnicę w elektroujemność. Inną możliwością wiązania metali są wiązania metalowe.
W połączenia metalowe występują między metalami, z częściowym uwalnianiem elektronów i tworzeniem chmury lub morza elektronów wokół atomów, co gwarantuje częściom metalowym właściwości przewodność elektryczne i ciągliwość.
Zobacz też: Przewodniki i izolatory – jakie są różnice?
Pozyskiwanie metali
Większość metali występuje naturalnie w skały i minerały związane z innymi pierwiastkami. Istnieje kilka technik rafinacji metali, takich jak elektroliza i reakcje chemiczne w celu oddzielenia związków.
W przypadku metali dwiema najczęściej stosowanymi na skalę przemysłową technikami uzyskania określonego stopnia czystości w metalu są: różnica gęstość i podatność magnetyczna (tendencja, że metal musi reagować na a pole magnetyczne).

rozwiązane ćwiczenia
Pytanie 1 - (Enem) Kadm obecny w akumulatorach może przedostać się do ziemi, gdy materiały te są nieregularnie usuwane do środowiska lub gdy są spalane. W przeciwieństwie do postaci metalicznej, jony Cd2+ są niezwykle niebezpieczne dla organizmu, ponieważ mogą je zastąpić Jony Ca2+ powodują chorobę zwyrodnieniową kości, czyniąc je bardzo porowatymi i powodując silny ból kości. stawy. Mogą również hamować enzymy aktywowane przez kation Zn2+, które są niezwykle ważne dla funkcjonowania nerek. Rysunek pokazuje zmienność promienia niektórych metali i ich odpowiednich kationów.
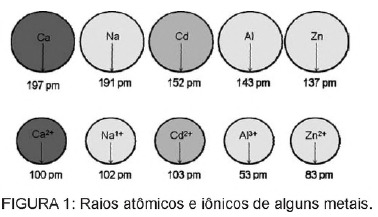
Z tekstu wynika, że toksyczność kadmu w postaci jonowej jest konsekwencją tego pierwiastka
A) wykazują niską energię jonizacji, co sprzyja powstawaniu jonu i ułatwia jego wiązanie z innymi związkami.
B) mają tendencję do działania w procesach biologicznych, w których pośredniczą kationy metali o ładunkach od +1 do +3.
C) mają promień i ładunek stosunkowo zbliżony do jonów metali, które działają na procesy biologiczne, powodując zakłócenia w tych procesach.
D) mają duży promień jonowy, dzięki czemu mogą ingerować w procesy biologiczne, w których zwykle uczestniczą mniejsze jony.
E) mają ładunek +2, co pozwala mu ingerować w procesy biologiczne, w których normalnie uczestniczą jony o niższych ładunkach.
Rozkład
Alternatywa C. Kadm to pierwiastek podobny do jonów metali, które naturalnie mamy w organizmie. Oprócz tego, że jest bioakumulacyjny, kadm, mając to podobieństwo do grup metalicznych, może wiązać się z grupami sulfhydrylowymi cząsteczek białka, powodując w ten sposób zmiany w procesach biologicznych, takich jak odwapnianie oraz niszczenie tkanek i krwinek czerwonych krew.
Pytanie 2 - Aby uzyskać właściwości istotne dla metali, zaznacz nieprawidłową alternatywę.
A) Większość metali jest dobrymi przewodnikami elektrycznymi i termicznymi.
B) Niektóre metale są podatne na utlenianie i/lub redukcję.
C) Żelazo jest metalem odpornym i plastycznym, co oznacza, że łatwo się go formuje.
D) Metale ziem alkalicznych mają tę nazwę „ziemia” w odniesieniu do tlenków tych metali, które mają ciemny kolor.
E) Metale to elementy o zróżnicowanej barwie i matowe, na skutek działania utleniania.
Rozkład
Alternatywa E. Metale są naturalnie błyszczące i mają metaliczny kolor, mogą ulegać utlenianiu, co powoduje zmiany właściwości istotnych dla aspekt części, ale nie jest to zjawisko występujące we wszystkich metalach, a w niektórych przypadkach utlenianie zależy od kilku czynników zewnętrzny.
przez Laysę Bernardes
Nauczyciel chemii

