W roku 1911 naukowiec z Nowej Zelandii Ernest Rutherford przedstawiony społeczności naukowej jego model atomowy. Model Rutherforda, zwany także modelem układu słonecznego, był trzecim w historii atomistyki (dwa pierwsze to model Dalton i model Thomsona) i był uważany za model, który stymulował całą ewolucję wiedzy o składniku materii, atomie.
Budowa Model Rutherforda rozpoczęto od badania właściwości promień rentgenowski oraz emisje radioaktywne, których kulminacją jest wykorzystanie promieniowania na obojętnym artefakcie, to znaczy takim, który nie reaguje łatwo.
Eksperyment przeprowadzony przez Rutherforda
Eksperyment przeprowadzony przez Rutherforda miał następującą aparaturę i organizację:
Komponent a - próbka polonu (emiter promieniowanie alfa) umieszczony na ołowianym bloku. W tym bloku znajdował się mały otwór, przez który przeszło promieniowanie;
Składnik b: bardzo cienkie złote ostrze umieszczone przed ołowianym pudełkiem;
Składnik c: Płytka metalowa pokryta materiałem fluorescencyjnym (siarczek cynku) umieszczona za, obok i nieco przed złotą płytką.
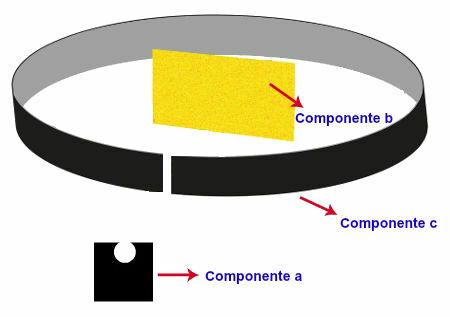
Reprezentacja eksperymentu przeprowadzonego przez Rutherford
Wyniki eksperymentu Rutherford
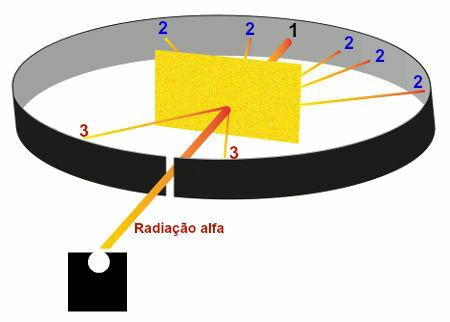
Reprezentacja wyników obserwowanych w eksperymencie Rutherford
Region 1: obszar, który otrzymał dużą część promieniowania alfa emitowanego przez polon, co wykazało, że promieniowanie to przeszło przez złotą płytę bez znacznych odchyleń;
Region 2: kilka obszarów, znajdujących się za złotą płytą, które otrzymały niewielką ilość promieniowania alfa, ale nie były w kierunku otwór wylotowy promieniowania w skrzynce ołowianej, co pokazało, że promieniowanie te uległo dużemu odchyleniu po złoto;
Region 3: obszary znajdujące się przed złotą płytką, które otrzymały wyjątkowo małą ilość promieniowania alfa, co pokazało, że część promieniowania alfa zderzyła się z płytą i została odbita z powrotem.
Interpretacje wyników eksperymentu Rutherford
Interpretacja o regionie 1: Ponieważ większość promieniowania alfa przeszła przez złotą płytkę bez przeszkód, oznacza to, że atomy miały duże puste przestrzenie (elektrosferę), czyli obszary, które nie miały nic zdolnego do wpływania na promieniowanie alfa;
Interpretacja o regionie 2: Niewielka ilość promieniowania alfa, która uległa odchyleniu, przeszła blisko dodatniego obszaru (jądra) atomu, prawdopodobnie o niewielkich rozmiarach, co sprzyjało odchyleniu.
Interpretacja o regionie 3: Ponieważ bardzo mała ilość promieniowania alfa została odbita, oznacza to, że zderzyły się z niezwykle małym obszarem atomu, który miał dodatnią charakterystykę.
Charakterystyka modelu atomowego Rutherforda
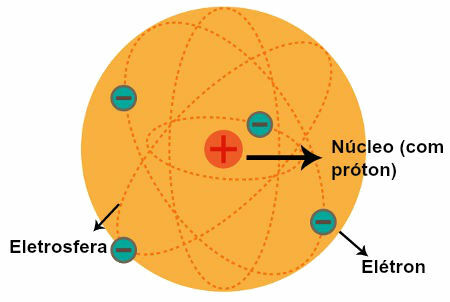
Reprezentacja modelu atomowego Rutherforda
Po obserwacjach Rutherforda sformułował swój model atomowy, który miał następujące cechy:
a) Jądro (które zostało porównane do Słońca w Układzie Słonecznym)
Centralny region atomu, który ma:
cząstki dodatnie ( protony);
niska głośność;
większa masa;
większy gęstość atomu.
b) Elektrosfery (które zostały porównane z orbitami opisanymi przez planety w Układzie Słonecznym)
Regiony atomu, które mają:
ogromne puste przestrzenie między nimi;
cząstki o charakterze negatywnym ( elektrony).
Przeze mnie Diogo Lopes Dias
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/o-atomo-rutherford.htm
