W siły międzycząsteczkowe to temat z chemii, który z pewnością może pojawić się na egzaminie National High School Exam (I albo). Dlatego warto zapoznać się z głównymi treściami tego tematu w tym artykule.
Definicja
siły międzycząsteczkowe są to siły – o różnym natężeniu (słabe, średnie lub silne) – przyciągania elektrostatycznego lub wiązania utworzone między cząsteczkami substancji, które utrzymują połączenie między nimi.
Rodzaje sił międzycząsteczkowych
) Indukowany dipol
A siła międzycząsteczkowa który występuje między cząsteczkami substancji o niepolarnej charakterystyce. Dzieje się to np. między cząsteczkami substancji takich jak O2, H2, nie2, CO2, CH4.
Połączenie między tymi cząsteczkami następuje, gdy powstaje między nimi dipol. Dzieje się tak, gdy elektrony z jednej cząsteczki wypierają elektrony z drugiej, tworząc w ten sposób biegun ujemny i dodatni, który jest przenoszony z jednej cząsteczki na drugą.
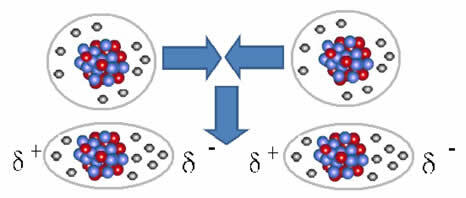
Reprezentacja tworzenia dipola w cząsteczkach niepolarnych
Pomiędzy tymi cząsteczkami powstały dwa bieguny, a biegun ujemny jednego oddziałuje z biegunem dodatnim drugiego. Ponieważ te bieguny zostały stworzone, jest to siła międzycząsteczkowa o niskiej intensywności.
B) stały dipol
A siła międzycząsteczkowa który występuje między cząsteczkami substancji o charakterystyce polarnej. Przykładami są cząsteczki substancji takich jak HCN, H2O, NH3, CO, CH3kl.
Połączenie między tymi cząsteczkami ma miejsce, gdy biegun ujemny jednej wchodzi w interakcję z biegunem dodatnim drugiej.
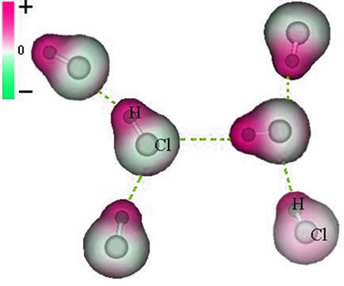
Reprezentacja stałej siły dipolowej między cząsteczkami HCl
Ponieważ bieguny już istnieją, siła międzycząsteczkowa stałego dipola ma większą intensywność niż dipol indukowany.
do) wiązania wodorowe
Że siła międzycząsteczkowa występuje między cząsteczkami polarnymi, które mają atom wodoru związany bezpośrednio z atomem tlenu, azotu lub fluoru.
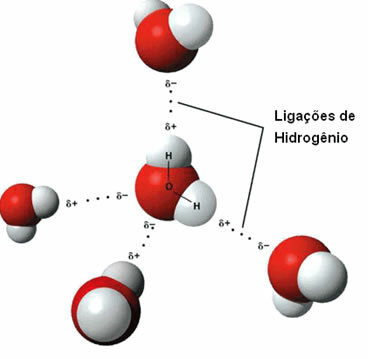
Reprezentacja wiązań wodorowych między cząsteczkami wody
Wiązanie wodorowe powstaje, gdy wodór w jednej cząsteczce wchodzi w interakcję z tlenem, azotem lub fluorem drugiej cząsteczki.
d) jon dipolowy
Ta siła międzycząsteczkowa występuje między cząsteczką polarną, która ma parę niewiążących elektronów, a jonem (kationem lub anionem) w roztworze.
Na przykład cząsteczka wody ma dwie pary niewiążących elektronów w tlenie. Jeśli w środowisku wodnym znajdują się jony, zbliżają się do cząsteczki wody, ponieważ są w niej bieguny.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Znaczenie
Znaczenie znajomości siły międzycząsteczkowe dla Enem jest to zrozumienie, jakie przynoszą w odniesieniu do stanów fizycznych, temperatury topnienia, temperatury wrzenia i rozpuszczalności substancji.
) Związek z temperaturą topnienia i wrzenia substancji
Temperatura topnienia wskazuje temperaturę przejścia ze stanu stałego do stanu ciekłego, a temperatura wrzenia wskazuje temperaturę przejścia ze stanu ciekłego w stan gazowy.
Ten fragment jest bezpośrednio związany z interakcją między cząsteczkami substancji, ponieważ tym, co odróżnia jeden stan fizyczny od drugiego, jest poziom agregacji między jej cząsteczkami.
Zatem im bardziej intensywna siła międzycząsteczkowa, tym wyższe temperatury topnienia i wrzenia. Im mniej intensywna siła międzycząsteczkowa, tym niższe temperatury topnienia i wrzenia. W ten sposób możemy zdefiniować malejący porządek temperatury topnienia i wrzenia:
Wiązanie wodorowe > stały dipol > indukowany dipol
B) Związek z rozpuszczalnością
Ogólnie musimy wiedzieć, że podobne rozpuszcza podobne, czyli substancja polarna rozpuszcza substancję polarną, a substancja niepolarna rozpuszcza substancję niepolarną.
Jednak nadal istnieje możliwość interakcji między cząsteczkami substancji rozpuszczonej a cząsteczkami rozpuszczalnika. Dzieje się tak tylko wtedy, gdy ta nowa interakcja jest większa niż to, co już istnieje między cząsteczkami samej substancji.
Przykład zastosowania siły międzycząsteczkowej w Enem
Pierwszy przykład: (Enem-2011) Dobrze nawilżona skóra ludzka nabiera elastyczności oraz miękkiego i gładkiego wyglądu. Z drugiej strony, gdy jest suchy, traci elastyczność i staje się nieprzejrzysty i szorstki. Aby zapobiec wysuszeniu skóry, w miarę możliwości należy stosować nawilżające środki nawilżające, zazwyczaj wykonane z gliceryny i glikolu polietylenowego:

Zatrzymywanie wody na powierzchni skóry, promowane przez środki nawilżające, jest konsekwencją oddziaływania grup hydroksylowych środków zwilżających z wilgocią zawartą w środowisku poprzez:
a) wiązania jonowe
b) siły londyńskie
c) wiązania kowalencyjne
d) siły dipol-dipol
e) wiązania wodorowe
Odpowiedzią na to pytanie jest wiązanie wodorowe, ponieważ cząsteczka wody ma wiązanie wodorowe z atomem tlenu. To samo dzieje się z cząsteczkami glikolu propylenowego i glikolu polietylenowego, co jest korzystnym warunkiem występowania tego typu sił międzycząsteczkowych.
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Siły międzycząsteczkowe w Enem”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Dostęp 27 czerwca 2021 r.
