W siły międzycząsteczkowe, ogólnie nazywana Siły Van der Waalsa, znajdują się trzy: dipol indukowany dipol indukowany, wiązania wodorowe i dipol stały dipol-stały. W tym tekście rozważymy tylko ostatnią z tych trzech sił:
Moc stały dipol-stały dipol, lub po prostu, dipol-dipol występuje tylko w cząsteczki polarne, czyli takie, które nie mają równomiernego rozkładu obciążenia na swojej powierzchni. Aby przytoczyć przykład, w cząsteczce HCl (gaz chlorowodorowy) chmura elektronowa jest bardziej przesunięta w kierunku atomu chloru, ponieważ jest bardziej elektroujemna niż wodór.
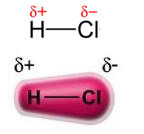
Zauważ, że wokół atomu chloru gromadzi się elektrony, co powoduje powstawanie a formation biegun ujemnysymbolizowanym przez grecką literę delta (-δ). W rezultacie w obszarze wokół atomu wodoru a biegun dodatni (+δ), ponieważ ma niską gęstość elektronową. Cząsteczka HCl stanowi następnie Dipole elektryczne a zatem w kontakcie z innymi sąsiednimi cząsteczkami HCl, między przeciwległymi biegunami cząsteczek występuje siła przyciągania, jak widać poniżej:
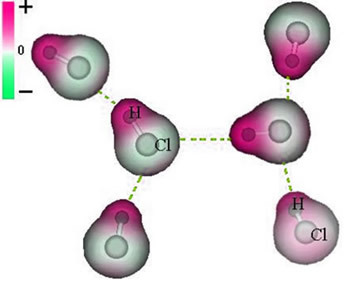
Ta siła przyciągania, która powstaje między ujemnym końcem dipola jednej cząsteczki a dodatnim końcem dipola innej cząsteczki, stanowi siłę dipol-dipol..
Jak sama nazwa wskazuje, dipol jest trwały, więc występuje tylko w związkach polarnych. A im wyższa polarność cząsteczki, tym intensywniejsze oddziaływania dipol-dipol w substancji.
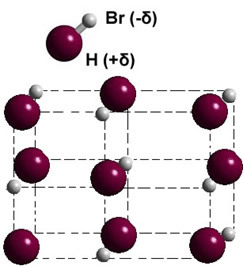
Jeśli jest w fazie stałej, tworzenie stałego dipola kieruje położeniem każdej cząsteczki w przestrzeni, tworząc kryształy dipolarne; jak w przypadku bromowodoru przedstawionego poniżej:
Inne przykłady substancji polarnych, które mają między cząsteczkami siłę dipolowo-dipolową to: H2S, CO, HCCl3, TYLKO2.
Ta siła międzycząsteczkowa wynosi średnia intensywność, ponieważ jest silniejsza niż siła przyciągania dipola indukowanego dipolem, ale mniej intensywna niż wiązanie wodorowe. Dlatego ich temperatury topnienia i wrzenia są wyższe niż substancji o indukowanej sile dipolowej. Ponieważ siła stałego dipola jest silniejsza, konieczne jest dostarczenie większej ilości energii, aby interakcje między jego cząsteczkami uległy rozkładowi.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm
