Gaz i para wodna
Różnica między gazem a parą jest podana na podstawie temperatury krytycznej. Para jest materią w stanie gazowym, który może ulec skropleniu wraz ze wzrostem ciśnienia. Gaz to nie to samo. Jest to płyn, którego nie można skroplić za pomocą prostego wzrostu ciśnienia. To sprawia, że gaz różni się od pary.
Zachowanie gazów
Dana substancja w stanie gazowym jest gazem, jeżeli jej temperatura jest wyższa niż temperatura krytyczna, jeżeli temperatura jest równa lub niższa od temperatury krytycznej, gdy substancja jest parą.
Rzeczywiste gazy, które normalnie znamy, takie jak hel, azot i tlen, mają różne i szczególne cechy molekularne każdego z nich. Jeśli jednak poddamy je wszystkim wysokim temperaturom i niskim ciśnieniom, zaczynają wykazywać bardzo podobne zachowanie. W badaniach gazów przyjmuje się nieistniejący w praktyce prosty model teoretyczny o zachowaniu zbliżonym do rzeczywistych gazów. To przybliżenie jest tym lepsze, im niższe ciśnienie i wyższa temperatura. Ten model gazu nazywa się
Około XVII i XIX wieku trzech naukowców (Jacques Charles, Louis J. Gay-Lussac i Paul E. Clayperon), po zbadaniu zachowania gazów, opracował prawa rządzące zachowaniem gazów doskonałych, zwanych również gazami doskonałymi. Wyznaczone przez nie prawa ustalają zasady „zewnętrznego” zachowania się gazu doskonałego, prowadząc do: zlicza tylko wielkości fizyczne, które są z nimi związane, czyli: objętość, temperatura i nacisk.
Ogólne prawo gazów doskonałych
Wyrażenie określające ogólne prawo dla gazów doskonałych można zobaczyć w następujący sposób:
Teraz nie przestawaj... Po reklamie jest więcej ;)
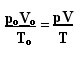
gdzie piO, VO oraz TO są odpowiednio ciśnieniem początkowym, objętością początkową i temperaturą początkową. To wyrażenie jest używane, gdy zmienne gazu się zmieniają.
Prawo Boyle'a
Robert Boyle, fizyk i chemik, był tym, który określił prawo rządzące przemianami gazu, gdy jego temperatura jest utrzymywana na stałym poziomie. Jego prawo mówi, że gdy gaz przechodzi przemianę izotermiczną, jego ciśnienie jest odwrotnie proporcjonalne do zajmowanej przez niego objętości. Z tego prawa wynika, że jak TO = T Musimy:
POVO = pV
Prawo Karola
Prawo Karola to prawo rządzące przemianami gazu doskonałego w stałą objętość. Te transformacje nazywane są transformacjami izochorycznymi lub izometrycznymi. Zgodnie z tym prawem, gdy doskonała masa gazu przechodzi przemianę izochoryczną, jej ciśnienie jest wprost proporcjonalne do jego temperatury bezwzględnej. Matematycznie prawo to można wyrazić następująco:

gdzie piO oraz TO to odpowiednio ciśnienie początkowe i temperatura początkowa.
Prawo Gay-Lussaca
Prawo Gay-Lussaca to prawo rządzące przemianami gazu doskonałego pod stałym ciśnieniem. Prawo to, mimo że nosi nazwę Gay-Lussac, zostało już odkryte przez fizyka i chemika A.C. Charlesa. Zgodnie z prawem, gdy gaz przechodzi przemianę izobaryczną, objętość gazu jest wprost proporcjonalna do jego temperatury bezwzględnej. Matematycznie prawo to można wyrazić następująco:

Gdzie VO oraz TO odpowiadają odpowiednio początkowej objętości i początkowej temperaturze.
Autor: Marco Aurélio da Silva
Zobacz więcej!!
Transformacje gazowe
Dowiedz się, czym są przemiany gazowe.
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
SANTOS, Marco Aurélio da Silva. „Badanie gazów”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Dostęp 27 czerwca 2021 r.