Ponieważ istnieją tysiące związków organicznych, zjawisko izomerii może przybierać różne formy. Dlatego izomeria można zasadniczo podzielić na dwa typy: izomeria płaska lub konstytucyjna i izomeria kosmiczna lub stereoizomeria. Każdy wymieniony typ można podzielić, jak pokazano na poniższym schemacie:
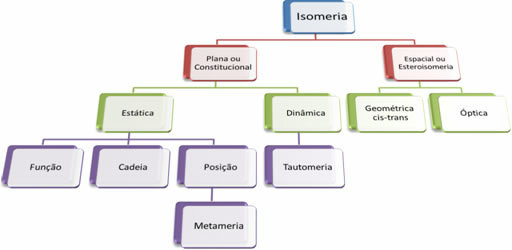
Zobacz każdy przypadek:
1. Izomeria płaska lub konstytucyjna: Izomery tego typu mają ten sam wzór cząsteczkowy i różnią się płaskimi wzorami strukturalnymi. Istnieje pięć przypadków płaskiej izomerii: funkcja, łańcuch, pozycja, metameria i tautomeria.
1.1.Izomeria funkcjonalna lub funkcjonalna: Różnica między izomerami dotyczy grupy funkcyjnej.
Przykład: Wzór cząsteczkowy C3H6O
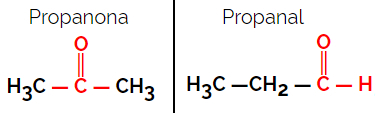
Należy zauważyć, że propanon pochodzi z grupy ketonowej, a propanal z grupy aldehydowej.
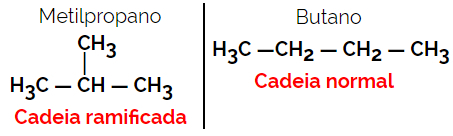
1.2. Izomery łańcuchowe lub szkieletowe: Różnica między izomerami polega na rodzaju łańcucha. Na przykład, jeden izomer ma łańcuch otwarty, a drugi łańcuch zamknięty, lub jeden ma łańcuch normalny, a drugi łańcuch rozgałęziony, lub jeden jest łańcuchem jednorodnym, a drugi łańcuchem heterogenicznym.
Przykład: Wzór cząsteczkowy C4H10
1.3.Izomeria pozycyjna lub pozycyjna: Różnica polega na położeniu nienasycenia, grupy funkcyjnej, heteroatomu lub podstawnika.
Przykład: Wzór cząsteczkowy C4H6

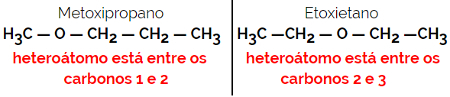
1.4.Izomeria kompensacyjna lub metametria: Jest to szczególny rodzaj izomerii pozycji, gdzie różnicą jest pozycja heteroatomu.
Teraz nie przestawaj... Po reklamie jest więcej ;)
Przykład: Wzór cząsteczkowy C4H10O
1.5.Izometria dynamiczna lub tautomery: Jest to szczególny rodzaj izomerii funkcji, w którym izomery współistnieją w dynamicznej równowadze w roztworze. Dwa główne typy tautomerii znajdują się między ketonem a enolem (równowaga ketoenolowa) oraz między aldehydem a enolem (równowaga aldoenolowa).
Przykład: Wzór cząsteczkowy C3H6O
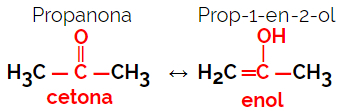
2. Izomeria kosmiczna lub stereoizomeria: W tym przypadku różnicę między izomerami można zwizualizować tylko poprzez orientację ich atomów w przestrzeni. Istnieją dwa rodzaje stereoizomerii: izomeria geometryczna i izomeria optyczna.
2.1.Izomery geometryczne lub cis-trans: Różnica polega na tym, że izomer nazwany jako cis ma te same ligandy węglowe w podwójnym wiązaniu lub w związkach cyklicznych po tej samej stronie płaszczyzny. Ligandy izomeryczne trans są po przeciwnych stronach.
Przykład: Wzór cząsteczkowy C2H2Cl2

Te związki są nazywane stereoizomery.
2.2.Izomer optyczny: Występuje, gdy izomery są w stanie odchylać spolaryzowaną wiązkę światła. Jeśli zagina spolaryzowaną wiązkę światła w lewo, jest to izomer lewoskrętny, ale jeśli zakrzywia się w prawo, nazywa się to izomerem prawoskrętnym.
Przykład:
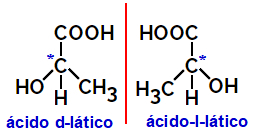
Cząsteczki asymetryczne, takie jak te pokazane powyżej, które są swoimi lustrzanymi odbiciami i które nie nakładają się na siebie, są nazywane enancjomery.
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Rodzaje izomerii”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm. Dostęp 28 czerwca 2021 r.
Funkcji, pozycji, funkcji, łańcucha, tautomery, łańcucha, łańcucha, metamery.
Pozycji, funkcji, łańcucha, łańcucha, tautomery, łańcucha, pozycji, metamery.
Z pozycji, z łańcucha, z łańcucha, z łańcucha, tautomery, z łańcucha, z pozycji, tautomery.
Z pozycji, z funkcji, z łańcucha, z funkcji, tautomery, z łańcucha, z pozycji, metametria.

