O obliczanie liczby cząstek atomowych służy do wskazania ilości protonów (w jądrze), elektronów (w elektrosferze) i neutronów (w jądrze) obecnych w dowolnym atomie lub jonie. Aby to zrobić, niezbędna jest znajomość niektórych cech atomów:
1- Liczba atomowa (Z)
Jest to kod matematyczny, reprezentowany przez wielką literę Z, umieszczony w lewym dolnym rogu skrótu atomu:
ZX
Wskazuje liczbę protonów (p) w jądrze i liczbę elektronów (e) w elektrosferze atomu. Tak więc ogólnie:
Z = p = e
2- Numer masowy (A)
Jest to kod matematyczny, który odpowiada sumie liczby protonów (p) i neutronów (n), które są obecne w jądrze dowolnego atomu. Równanie reprezentujące liczbę masową dana jest wzorem:
A = p + n
Ponieważ liczba protonów jest równa liczbie atomowej, równanie obliczające liczbę masową możemy napisać w następujący sposób:
A = Z + n
Znając liczbę masową i liczbę atomową atomu, możemy określić liczbę neutronów w następujący sposób:
n = A - Z
3- jony
Są to atomy, które tracą lub zyskują elektrony. Mają znak dodatni lub ujemny umieszczony w prawym górnym rogu ich reprezentacji, tak jak w następującym modelu:
X+ lub X-
Jon dodatni: Nazywa się to kationem, a znak dodatni wskazuje, że stracił elektrony.
Jon ujemny: Nazywa się to anionem, a znak ujemny wskazuje, że zyskał elektrony.
Teraz nie przestawaj... Po reklamie jest więcej ;)
4- Podobieństwa atomowe
a) Izotopy
Atomy o tej samej liczbie atomowej i różnych liczbach masowych. Przykład:
7X14 i 7Tak16
Atomy X i Y mają tę samą liczbę atomową (na lewo od akronimu), czyli równą 7. Atom X ma liczbę masową (po prawej stronie akronimu) równą 14, a atom Y ma liczbę masową równą 16.
b) Izobary
Atomy, które mają tę samą liczbę masową i różne liczby atomowe. Przykład:
15X31 i 13Tak31
Atomy X i Y mają liczbę masową (po prawej stronie akronimu) równą 31. Z drugiej strony atom X ma liczbę atomową równą 15, a atom Y ma liczbę atomową równą 13.
c) Izotony
Atomy, które mają różne liczby masowe i atomowe, ale tę samą liczbę neutronów.
d) Izoelektronika
Atomy, które mają taką samą liczbę elektronów. Przykład:
12X+2 i 7Tak-3
Atom X ma liczbę atomową równą 12 i jest kationem (o ładunku dodatnim +2), więc traci dwa elektrony, a więc ma 10 elektronów w swojej elektrosferze. Z drugiej strony atom Y ma liczbę atomową równą 7 i jest anionem (o ładunku ujemnym -3), więc zyskuje trzy elektrony, a więc ma 10 elektronów w swojej elektrosferze.
Mapa myśli: Cząstki atomowe
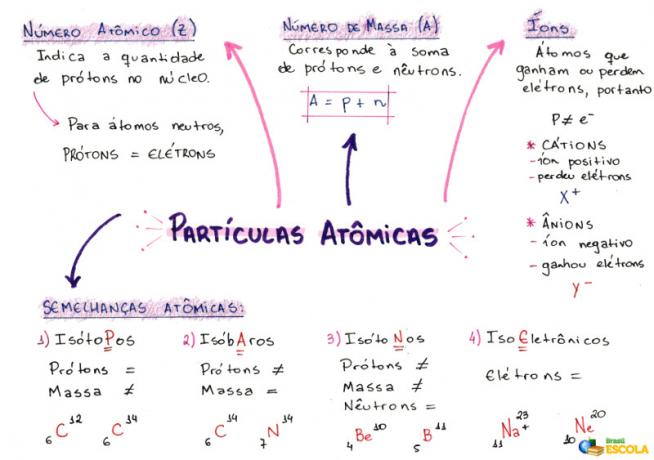
* Aby pobrać mapę myśli w formacie PDF, Kliknij tutaj!
Przykłady obliczania liczby cząstek atomowych
Przykład 1: Określ liczbę protonów, neutronów i elektronów w atomie 14X29.
Podano następujące wartości dla atomu X:
Numer masowy (prawy górny róg) = 29
Liczba atomowa (na dole po lewej) = 14
Aby określić liczbę protonów:
Liczba protonów jest zawsze równa liczbie atomowej, więc atom X ma 14 protonów.
Aby określić liczbę elektronów:
Ponieważ atom X nie jest jonem, liczba elektronów jest równa liczbie protonów, czyli 14.
Aby określić liczbę neutronów:
Liczbę neutronów określa się za pomocą liczby mas i protonów według następującego wzoru:
A = p + n
29 = 14 + n
29 - 14 =n
n = 15
Przykład 2: Wyznacz liczbę protonów, neutronów i elektronów jonu X+3, wiedząc, że ich liczba masowa i liczba atomowa wynoszą odpowiednio 51 i 23.
Podano następujące wartości dla jonu X:
Liczba masowa = 51
Liczba atomowa (na dole po lewej) = 23
Aby określić liczbę protonów:
Liczba protonów jest zawsze równa liczbie atomowej, więc atom X ma 23 protony.
Aby określić liczbę elektronów:
Jon X jest dodatni (+3), więc jest to kation, który stracił trzy elektrony. Więc jego liczba elektronów wynosi 20.
UWAGA: Zmniejszenie lub zwiększenie liczby elektronów następuje zawsze w stosunku do liczby atomowej.
Aby określić liczbę neutronów:
Liczbę neutronów określa się za pomocą liczby mas i protonów według następującego wzoru:
A = p + n
51 = 23 + n
51 - 23 = n
n = 28
Przykład 3: Atom W ma liczbę atomową i masę równą odpowiednio 29 i 57, będąc izobarem a atom Y, który ma liczbę atomową równą 30, który jest izotopem atomu B, którego liczba masowa wynosi 65. Mając te informacje, określ liczbę protonów, neutronów i elektronów w atomie B.
Dane dostarczone przez ćwiczenie:
Atom W
liczba atomowa (na dole po lewej) = 29
liczba masowa (prawy górny róg) = 57
Y isobar, czyli masa Y również wynosi 57.
atom Y
liczba atomowa = 30
liczba masowa = 57
Mając te dwie wartości, musimy określić jego liczbę neutronową, ponieważ jest to izoton pierwiastka B:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
Grób:
liczba masowa = 65
liczba neutronów = 27
Mając te dane, musimy określić jego liczbę atomową, ponieważ dzięki temu będziemy określać jego liczbę protonów i liczbę elektronów (ponieważ nie jest jonem):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Dlatego atom B ma 38 protonów, 38 elektronów i 27 neutronów.
* Mapa myśli autorstwa Victora Ricardo Ferreira
Nauczyciel chemii
Przeze mnie Diogo Lopes Dias
