w reakcje dodawaniaw alkeny(węglowodory, które mają podwójne wiązanie między dwoma atomami węgla), wiązanie pi między dwoma atomami węgla zostaje zerwane i każdy z węgli przyłącza się do nowego atomu. Popatrz:
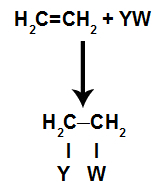
Ogólny schematyczny model reakcji addycji
Zasady reakcji addycji
a) Zerwanie połączenia pi
Wiązanie pi jest łatwo zerwane, ponieważ jest słabsze niż wiązanie sigma. Jednak aby tak się stało, konieczne jest poddanie alkenu warunkom zapewniającym to zakłócenie. Po zerwaniu wiązania pi między dwoma węglami, miejsce wiązania (dla nowych atomów) zawsze pojawia się na każdym z zaangażowanych węgli.
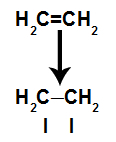
Schemat przedstawiający pęknięcie ogniwa pi
b) Warunki zerwania wiązania pi
Czynniki sprzyjające zerwaniu wiązania pi to:
Stosowanie katalizatorów;
Ogrzewanie;
Obecność kwasu w środowisku reakcyjnym.
c) Wystąpienie reakcji addycji
Miejsca wiązania utworzone po zerwaniu wiązania pi będą zawsze zajęte przez atomy reagenta, który znajduje się w tym samym pojemniku co alken. Nazwa reakcji addycji pochodzi od rodzaju odczynnika zmieszanego z alkenem.
Rodzaje reakcji addycyjnych w Alkenach
a) Uwodornianie
Alken miesza się z gazowym wodorem (H2) w pojemniku i poddane działaniu stałego katalizatora (niklu, platyny lub palladu) i ogrzewaniu (Δ).
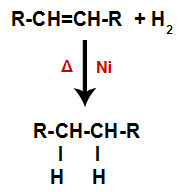
Ogólny schemat reakcji uwodornienia w alkenach
Obecność katalizatora i ogrzewanie powodują powstanie wiązania pi alkenu i wiązania sigma pomiędzy wodorami H2 szybciej się zepsuć. Dzięki temu mamy utworzenie dwóch miejsc wiązania w alkenach i dwóch wolnych atomów wodoru w medium reakcyjnym.

Tworzenie miejsc wiązania i rozdzielania atomów
Zatem zaraz potem każdy wolny atom wodoru zajmuje jedno z miejsc wiązania utworzonych w alkenie. Ponieważ utworzona substancja ma tylko węgle i wodory, a także tylko proste wiązania między węglami, jest to a alkany.
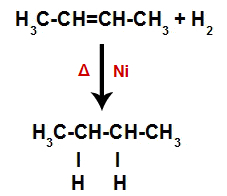
Równanie przedstawiające tworzenie alkanu podczas uwodorniania
B) Halogenacja
Alken miesza się z prostymi substancjami (F2, Cl2, br2 Hej2) utworzony przez halogeny (chlor, fluor, jod i brom) w pojemniku i poddawany działaniu światła (λ) i ogrzewania (Δ).

Ogólny schemat reakcji halogenowania w alkenach
Działanie światła i ogrzewania powoduje szybsze zerwanie wiązania pi alkenu i wiązania sigma między substancjami utworzonymi przez halogen. Dzięki temu mamy utworzenie dwóch miejsc wiązania w alkenach i dwóch wolnych atomów halogenu w medium reakcyjnym.
Teraz nie przestawaj... Po reklamie jest więcej ;)

Tworzenie miejsc wiązania i rozdzielania atomów
W ten sposób, bezpośrednio potem, każdy wolny atom halogenu zajmuje jedno z miejsc wiązania utworzonych w alkenie. Ponieważ utworzona substancja ma halogen połączony ze strukturą złożoną z węgli i wodorów, jest to halogenek organiczny.

Równanie przedstawiające tworzenie halogenków organicznych w halogenowaniu
c) Nawodnienie
Alken miesza się z wodą (H2O) w pojemniku i poddane działaniu katalizatora (w tym przypadku kwasu siarkowego).
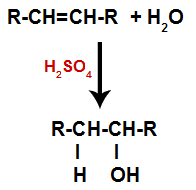
Ogólny schemat reakcji hydratacji w alkenach
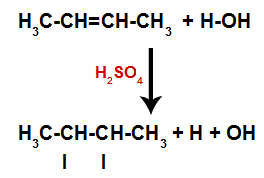
Obecność kwasu siarkowego w reakcji sprawia, że wiązanie pi alkenu i wiązanie sigma między wodorem (H) i hydroksylem (OH) wody szybciej pękają. Dzięki temu mamy utworzenie dwóch miejsc wiążących w alkenach oraz jednego wolnego wodoru i jednego hydroksylu w medium reakcyjnym.
Tworzenie miejsc wiązania i rozdzielania atomów
Tak więc wkrótce potem wodór i hydroksyl zajmują jedno z miejsc wiązania utworzonych w alkenie. Ponieważ powstała substancja ma hydroksyl związany z węglem nasyconym (tworzy tylko wiązania proste), jest to alkohol.
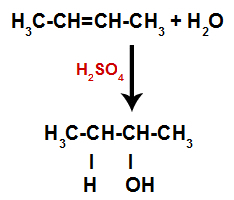
Równanie przedstawiające powstawanie alkoholu w hydratacji
d) Dodatek z halogenowodorami
Alken miesza się z chlorowcowanym kwasem nieorganicznym (HF, HI, HCl, HBr) w pojemniku.

Ogólny schemat reakcji halogenku kwasowego w alkenach
Obecność kwasu w reakcji powoduje szybsze pękanie wiązania pi alkenu. Pojedyncze wiązanie w kwasie zostaje zerwane, ponieważ substancje te naturalnie jonizują. W ten sposób w alkenie powstają dwa miejsca wiązania, aw środowisku reakcji występuje wolny wodór i halogen.
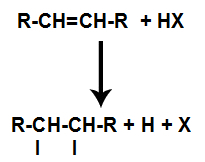
Tworzenie miejsc wiązania i rozdzielania atomów
Tak więc wkrótce potem wodór i halogen zajmują jedno z miejsc wiązania utworzonych w alkenie. Ponieważ utworzona substancja ma halogen połączony ze strukturą złożoną z węgli i wodorów, jest to halogenek organiczny.
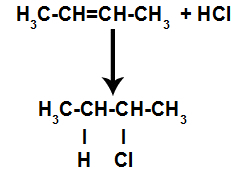
Równanie przedstawiające tworzenie halogenków organicznych w halogenowaniu
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Reakcje addycyjne w alkenach”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm. Dostęp 28 czerwca 2021 r.
Chemia

Alkany, węglowodory, metan, łańcuchy nasycone, alifatyczne, parafiny, paliwa, benzyna, wosk mineralny, ropa naftowa, łupki naftowe, gaz ziemny, przemysł petrochemiczny.
Chemia

Alkeny, gaz, eten, etylen, tworzywa sztuczne, kauczuk syntetyczny, barwniki, tkaniny syntetyczne, materiały wybuchowe, kraking naftowy, polietylen, oleje, olefiny, węglowodory, łańcuch, acykliczny dwutlenek węgla.
Alkiny, węglowodory etyczne, węglowodory acetylenowe, acykliczny łańcuch węglowy, łańcuch węglowy jednorodny, nienasycony łańcuch węglowy, potrójne wiązanie, PVC, PVA, acetylen, kauczuki syntetyczne, tworzywa sztuczne, druty tekstylia.