TEN stereoizomeria, znany również jako Izomeria kosmiczna, to rodzaj izomerii, w której jego izomery różnią się wiązaniami między ich atomami ułożonymi w różny sposób w przestrzeni.
Istnieją dwa rodzaje stereoizomerów, diastereoizomery i enancjomery. Diastereoizomery to izomery geometryczne typu cis-trans, które nie są swoimi lustrzanymi odbiciami, natomiast enancjomery są izomerami optycznymi, które są swoimi lustrzanymi odbiciami.
Mówiąc trochę o diastereoizomer cis-trans, występuje tylko w związkach nienasyconych lub cyklicznych. Dlaczego nie występuje w związkach o łańcuchach nasyconych, czyli takich, które mają tylko pojedyncze wiązania między węglami?
Może się zdarzyć, że pomylimy się myśląc, że pewne związki nasycone są diastereoizomerami, podczas gdy w rzeczywistości reprezentują ten sam związek. Na przykład poniżej mamy trzy przestrzenne konformacje atomów 1,2-dichloroetanu:
H H H H H Cl
│ │ │ │ │ │
H — DO — DO — H H — DO — DO — ClH — DO — DO — H
│ │ │ │ │ │
Cl ClCl H Cl H
Teraz nie przestawaj... Po reklamie jest więcej ;)
Czy to są trzy diastereoizomery? Nie rób. Tak właściwie, trzy cząsteczki są tego samego związku. Dzieje się tak, że pojedyncze wiązania lub sigma (σ) między węglami mogą podlegać rotacji, co skutkuje różnymi układami atomowymi.
Zobacz, jak to się dzieje na poniższym schemacie z etanem:

Te związki, które w rzeczywistości są tym samym związkiem, nie wykonują geometrycznej izomerii cis-trans, ale są nazywane izomery konformacyjne, ponieważ różnią się jedynie konformacją ich atomów spowodowaną rotacją wokół pojedynczego wiązania.
Jednym ze sposobów przedstawienia tych cząsteczek w celu ułatwienia wizualizacji obrotu osi połączenia jest użycie through projekcja Newmana, w którym uważa się, że płaszczyzna widzenia znajdowała się dokładnie na osi wiązania między węglami i są one reprezentowane przez okrąg centralny. Zobacz projekcję Newmana dla etanu:

Możemy również reprezentować te różne konformacje poprzez formuła na sztalugach:
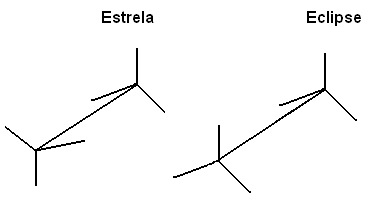
Ta swobodna rotacja osi połączenia nie występuje już w związkach nienasyconych lub w cyklach. Na przykład wyobraźmy sobie, że budujemy prosty model, przedstawiający dwa węgle za pomocą dwóch kulek styropianowych połączonych wbitą w nie wykałaczką.
Gdy mamy jedną wykałaczkę i trzymamy jedną z kulek, druga może się swobodnie obracać wokół własnej osi, tak jak to ma miejsce przy zwykłym wiązaniu.

Jeśli jednak włożymy jeszcze jedną wykałaczkę łączącą dwie kule, nie będziemy w stanie utrzymać jednej kuli i obracać drugiej. Jeśli to zrobimy, wykałaczki pękną. Podobnie, gdy istnieje wiązanie pi i sigma (wiązanie podwójne), występuje przeszkoda w rotacji węgli.
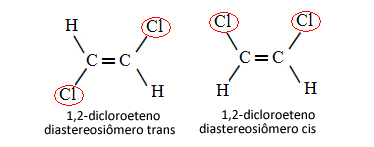
Dlatego w poniższym przypadku, w którym między węglami mamy wiązanie podwójne, nie chodzi o dwa izomery konformacyjne, czyli o dwie konformacje dla tej samej cząsteczki; tak naprawdę mamy dwa diastereoizomery cis-trans:
Więcej na temat tego typu izomerii znajdziesz w tekście Izomery geometryczne lub cis-trans.
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Izomeria konformacyjna”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/isomeria-conformacional.htm. Dostęp 28 czerwca 2021 r.