podwójna sól to nazwa nadana jednej z klasyfikacji, które sole nieorganiczne Może odbierać. Pozostałe klasyfikacje to: proste, ałunhydroksylowany, uwodorniony i nawodniony. Aby być scharakteryzowana jako sól podwójna, sól nieorganiczna musi mieć jedną z kombinacji opisanych poniżej:
Kation (Y) i dowolne dwa aniony (X i W) i jest reprezentowany przez następujący wzór:
YXW
Anion (X) i dowolne dwa kationy (Y i Z) przedstawia następujący wzór:
YZX
Uwaga: Te sole powstają, gdy Reakcja neutralizacji jest wykonywany między dwojgiem podstawy inny i jeden kwaslub między dwoma różnymi kwasami i zasadą.
Zasada nazewnictwa dla podwójnej soli
Aby nazwać podwójna sól, trzeba najpierw poznać jej budowę, ponieważ dla każdego rodzaju soli podwójnej istnieje specyficzna zasada nazewnictwa, jak widać poniżej:
a) Reguła nomenklatury dla soli podwójnej z dwoma kationami
Kiedy jeden podwójna sól ma dwa kationy, musimy zastosować następującą zasadę:

Reguła nomenklatury stosowana dla soli podwójnych z dwoma kationami
Oto dwa przykłady zastosowania tej reguły nazewnictwa:
Pierwszy przykład: Linia4s
Ta sól składa się z:
Anion: siarczek (S-2);
Więcej kationów elektrododatnich: lit (Li+1);
Mniej elektrododatni kation: amon (NH4+1).
Stąd jego nazwa to (podwójny) siarczek amonu litu.
Drugi przykład: RbCaBO3
Ta sól składa się z:
Anion: boran (BO3-3);
Bardziej elektrododatni kation: rubid (Rb+1);
Mniej kationów elektrododatnich: wapń (Ca+2).
Tak więc jego nazwa to boran (podwójny) rubidu i wapnia.
b) Reguła nomenklatury dla soli podwójnej z dwoma anionami
Kiedy jeden podwójna sól ma dwa aniony, musimy zastosować następującą zasadę:
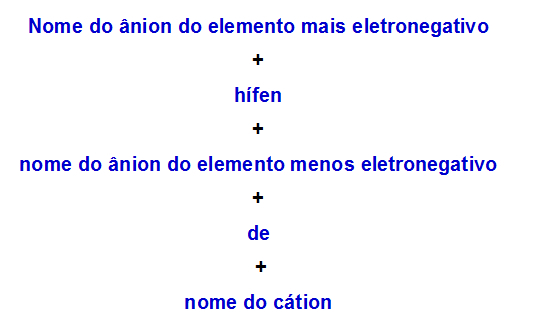
Reguła nomenklatury stosowana dla soli podwójnych z dwoma anionami
Teraz nie przestawaj... Po reklamie jest więcej ;)
Oto dwa przykłady zastosowania tej zasady:
Pierwszy przykład: MgFI
Ta sól składa się z:
Kation: magnez (Mg+2);
Najbardziej elektroujemny anion: fluorek (F-1);
Mniej elektroujemny anion: jodek (I-1).
Dlatego jego nazwa to fluorek magnezu.
Drugi przykład: ZnNO2br
Ta sól składa się z:
Kation: cynk (Zn+2);
Więcej elektroujemnych anionów: azotyn (NO2-1);
Mniej elektroujemny anion: bromek (Br-1).
Stąd jego nazwa to bromek azotynu cynku.
Zestawienie formuły soli podwójnej z jej nomenklatury
a) Dla soli podwójnej z dwoma kationami
Konstrukcja formuły a podwójna sól polega na znajomości jego nazwy, która jest standaryzowana jak w każdej soli, czyli najpierw kation, a potem anion. Ponieważ sól podwójna może mieć dwa kationy, ich kolejność i rozmieszczenie w formule są zgodne z podaną nazwą.
Pierwszy przykład: pirofosforan barowo-niklowy II
Ta sól zawiera fosforan (P2O7), bar (Ba+2) i nikiel II (Ni+2), kationy zapisane w tej kolejności. Więc jego formuła to BaNiP2O7.
Drugi przykład: fosforan miedzi II i złoto I
Ta sól zawiera fosforan (PO4-3), miedź II (Cu+2) i złoto I (Au+1), kationy zapisane w tej kolejności. Dlatego jego formuła to CuAuPO4.
b) Do soli podwójnej z dwoma anionami
W przypadku podwójna sól przy dwóch anionach kierujemy się również, umieszczając aniony we wzorze, kolejnością, w jakiej występują w podanej nazwie.
Pierwszy przykład: jodek siarczanu niklu III
Ta sól ma aniony siarczanowe (SO4-2) i jodek (I-1), zapisane w tej kolejności, oraz kation niklu III (Ni+3). Więc jego formuła to NiSO4JA.
Drugi przykład: fosforan cyjanku ołowiu IV
Ta sól zawiera aniony fosforanowe (PO4-3) i cyjanek (CN-1), zapisany w tej kolejności, oraz kation ołowiu IV (Pb+4). Więc jego formuła to PbPO4CN.
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. „Co to jest podwójna sól?”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-sal-duplo.htm. Dostęp 28 czerwca 2021 r.
Nomenklatura soli, klasyfikacja soli, nazwa anionu, nazwa kationu, siarczan żelaza, siarczan żelaza, azotan srebra, chlorku potasu, chlorku sodu, chlorku wapnia, azotanu srebra, siarczanu miedzi, węglanu wapń.
Chemia

Sole codziennego użytku, węglan wapnia, chlorek sodu, fluorek sodu, azotan potasu, azotan sodu węglan sodu, wodorowęglan sodu, wodorowęglan sodu, siarczyn sodu, saletra, Soda.
