Saltsyre er et hydrosyre med høyt ioniseringspotensial, det er en gulaktig væske, svært etsende og giftig. Den brukes i forskjellige industrielle prosesser, slik som fremstilling av rengjøringsprodukter og farmasøytiske hydroklorider, i matvarer og i stålfremstillingsprosesser.
Det er også til stede i den menneskelige organismen; O magesaft som virker i fordøyelsen av proteiner er en sur løsning; av saltsyre og andre stoffer, som f.eks enzymer og salter. Eksponering, innånding eller svelging av konsentrert saltsyre er svært helseskadelig, som til og med kan forårsake død.
Les også: Svovelsyre - stoff som har høy etsende kraft
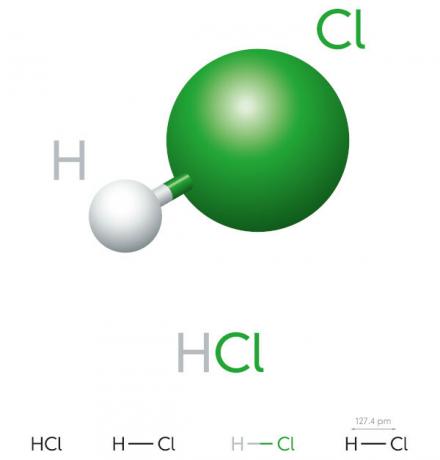
Saltsyreegenskaper
- uorganisk forbindelse
- sterk syre
- Høyt ioniseringspotensial
- Væske
- gulaktig utseende
- Giftig
- Etsende
- Flyktige
- Hygroskopisk (har en tendens til å absorbere ávann av miljøet)
- Løselig i vann
Saltsyreproduksjon
Saltsyren var oppdaget av en muslimsk alkymist kalt Jabir Ibne Haiane, også kjent som Gaber og betraktet som faren til arabisk kjemi. Han syntetiserte stoffet basert på en
reaksjon mellom havsalt (NaCl) og svovelsyre (På2KUN4).2NaCl + H2KUN4 → I2KUN4 + 2HCl
For tiden saltsyre produseres i stor skala gjennom elektroniskólysis av natriumklorid i vandig løsning. Fra denne prosessen oppnås gass klor (Cl2), gass hydrogen (H2) og natriumhydroksid (NaOH). Klor- og hydrogengasser reagerer for å danne saltsyre:
Cl2 + H2 → 2HCl
Derimot, denne reaksjonen er ekstremt eksoterm og svært farlig. For tiden er det meste av saltsyren som produseres industrielt, forbundet med produksjonen av organiske forbindelser, noe som er en mer økonomisk og tryggere prosess.
R-H + Cl2 → R-Cl + HCl
(Betrakt R som en organisk radikal.)
Se også: Tips for å bestemme-hvis styrken av syrer

Saltsyre påføring
- Beising av metall: Saltsyre brukes til å "rense" metaller før de behandles, og fjerner rust, kalk og andre urenheter fra overflaten.
- Produksjon av organiske forbindelser: saltsyre brukes som et reagens for å oppnå vinylklorid, som brukes til fremstilling av plast. Saltsyre kommer også fra kloropren, som brukes i syntetisk gummi.
- Produksjon av uorganiske forbindelser: saltsyre er til stede i flere industrielle prosesser for fremstilling av reagenser og forbindelser uorganiske stoffer, blant dem er produkter for vannbehandling, som jern (III) klorid og aluminium.
- Brukt som rengjøringsmiddel: Saltsyre blir også markedsført som muriatsyre, og brukes til rengjøring av verktøy og maskiner etter bygging, husholdning og kjemisk rengjøring.
- Matforedling: Saltsyre brukes i forskjellige reaksjoner for produksjon av mat og tilsetningsstoffer, som hydrolyse av stivelse og proteiner, eller i sluttproduktet for pH-balanse.
- Legemiddelproduksjon: Saltsyre brukes i produksjonen av oppløselige hydroklorider som er tilstede i flere medikamenter, for eksempel doksycyklinhydroklorid, brukt til behandling av tyfoidfeber og kopper.
Saltsyre i kroppen
Saltsyre er til stede i vår Fordøyelsessystemet, magesaften som produseres av magen vår, er en løsning av vann, enzymer, saltsyre, uorganiske salter og en liten andel melkesyre.
O matkake blir omgjort til chyme, en sur masse (takket være virkningen av magesaft og dens sure sammensetning), er dette når fordøyelse av proteiner, forvandlet til polypeptider og aminosyrer som vil bli absorbert av kroppen.
Saltsyrefare
Saltsyre er en veldig sterk og etsende syre, så kontakt med stoffet forårsaker flere skader:
- Hud: Gir etseskader og irritasjon.
- Øyne: Forårsaker alvorlig irritasjon og kan forårsake blindhet.
- Innånding: Gir irritasjon og skade på øvre luftveier.
- svelging: forårsaker korrosjon i det orale systemet, og i mage-tarmkanalen kan det forårsake oppkast, blødning, diaré, sirkulasjonsproblemer, noe som kan føre til døden.
- Eksponeringfortsettelse følger: angriper slimhinneområdene først, forårsaker dermatitt og konjunktivitt, blødende tannkjøtt, fotosensibilisering; hyppig innånding, selv i lav konsentrasjon av forbindelsen, kan forårsake gastritt og neseblod.
Også tilgang: Kjennetegn og egenskaper til eddiksyre

løste øvelser
Spørsmål 1 - (Udesc) Når det gjelder saltsyre, kan det fastslås at:
A) når den er i vandig løsning, tillater den strøm av elektrisk strøm.
B) er en syre.
C) er en svak syre.
D) har en lav grad av ionisering.
E) er et ionisk stoff.
Vedtak
Alternativ A. Saltsyre er ikke en syre, da den bare har en ioniserbar H, men en sterk syre, molekylært stoff med høyt ioniseringspotensial. DE ionisering i et vandig medium fremmer ledningen av elektrisk strøm på grunn av eksistensen av frie ioner.
Spørsmål 2 - I en løsning av saltsyre og vann kan vi si at forekomsten av molekylært hydrogenklorid (HCl) er minimal, dette er fordi
A) Saltsyre i kontakt med vann fortynnes.
B) hydrogenklorid er et stoff som ikke løses i vann.
C) hydrogenklorid har et høyt ioniseringspotensial, derfor, når det er i et vandig medium, danner HCl-molekylet H-ioner+ Cl-.
D) saltsyren, som er veldig flyktig, skiller seg fra løsningen og etterlater bare vannmolekyler.
E) saltsyre er et ionisk stoff, derfor dissosieres det i en vandig løsning og danner ioner.
Vedtak
Alternativ C.
A) Svaret stemmer ikke overens med spørsmålet, fortynning av saltsyre i vann rettferdiggjør ikke fraværet av molekylær HCl.
B) Feil, hydrogenklorid er løselig og har en affinitet for vann.
C) Riktig
D) Selv om saltsyre er flyktig, forekommer denne segregeringen av de to artene i løsningen ikke signifikant.
E) Saltsyre er en løsning av hydrogenklorid og vann, der hydrogenklorid er et ikke-ionisk molekylært stoff.
Av Laysa Bernardes Marques de Araujo
Kjemi lærer
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm
