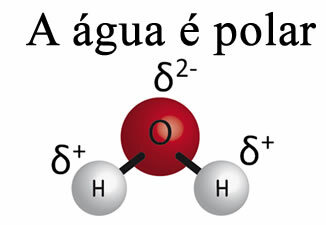
Vann alene kan ikke fjerne fett fra materialene. Dette er fordi Devannet er polar, som vist på bildet nedenfor, på grunn av forskjellen i elektronegativitet som eksisterer mellom hydrogen- og oksygenatomene i molekylene deres. På den andre siden, fettet er ikke-polært og derfor løser ikke vann opp fett.
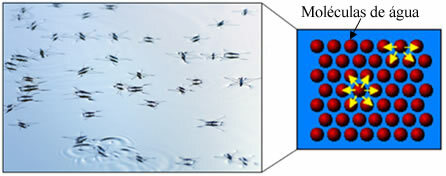
I tillegg har vann noe som heter overfladisk spenning. Du kan forstå dette bedre i teksten. Overflatespenning av vann, men i utgangspunktet er det en slags elastisk film eller membran som dannes på overflaten av vann, som forhindrer den i å trenge gjennom tekstiler og andre materialer for å fjerne smuss. Vannmolekyler tiltrekker hverandre i alle retninger hydrogenbindinger, men overflatemolekyler samhandler bare med molekyler på siden og under, og skaper en forskjell i samholdskrefter, som får overflatemolekylene til å trekke seg sammen og danne denne overflatespenningen.
Det er der såper og vaskemidler kommer inn (fra latin avgifte = clear), som også kalles overflateaktive midler, da de har evnen til å redusere overflatespenningen til vann og i tillegg samhandle med både vann og fett.
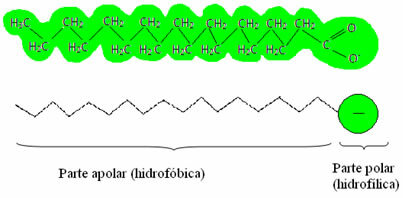
Hvordan skjer dette?Såper og vaskemidler har fettsyresalter, som er lange molekyler dannet av en ikke-polær del (hva er hydrofob – hydro = vann; phobes = aversjon) og en polarenden (hydrofile – hydro = vann; phyla = venn). Nedenfor har vi en typisk struktur av en såpe:
Ikke stopp nå... Det er mer etter annonseringen;)
Vanligvis er vaskemidler salter av langkjedede sulfonsyrer:
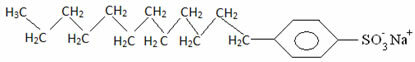
Dermed samhandler den ikke-polare delen av disse molekylene i såper og vaskemidler med fettet, mens polarenden samhandler med vann og grupperer seg i små kuler, ringte fra miceller, hvor de hydrofile delene vender ut mot micellen i kontakt med vannmolekylene, og fett forblir på innsiden, i kontakt med den ikke-polare eller hydrofobe delen, en prosess som ligner den som er vist på bildet a Følg:
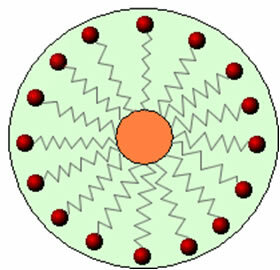
På denne måten blir det fettete smusset fanget i midten av micellene og kan fjernes. Et annet poeng er at vaskemidler og såper har evnen til å senke vanns overflatespenning, fordi redusere interaksjonene mellom molekylene, og dermed gjøre det lettere for den å trenge gjennom forskjellige materialer for å fjerne skitt.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Kjemi av såper og vaskemidler"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/quimica-dos-saboes-detergentes.htm. Tilgang 28. juni 2021.
Vaskemidler og forurensning, såperester blir spaltet av mikroorganismer i vann fra elver, biologisk nedbrytbare stoffer, vaskemidler, skumlag som hindrer oksygengass i å komme inn i vannet, kjeder forgrenet.
Kjemi

Syntetiske stoffer, metylen-dimetoksy-metamfetamin, sterkt psykoaktivt stoff, ecstasy, MDMA, sakkarin, cyklamat, plast, akryl, vaskemidler, naturgummi, organisk gummi, syntetisk gummi, hydrokarboner syntetisk, remskive