Polariteten til molekyler er et veldig viktig aspekt, ettersom egenskapene til stoffer bestemmes blant annet av det faktum at molekylene deres er polære eller ikke-polare.
Bestemmelsen av polariteten til et molekyl kan utføres ved hjelp av Dipole Moment eller Resulterende Dipole Moment, hvis symbol er 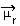 . Hvis vi bare snakker om dipolmomentet til hver binding i molekylet, er symbolet den greske bokstaven mi (µ).
. Hvis vi bare snakker om dipolmomentet til hver binding i molekylet, er symbolet den greske bokstaven mi (µ).

Molekylet vil være upolært hvis dipolmomentet er lik null, men hvis det ikke er null, betyr det at det er polært.

Det er to viktige ting å vurdere når man bestemmer dette resulterende dipolmomentet. La oss se hva de er:
1) elektronegativitetsforskjell mellom atomene til elementene som deltar i reaksjonen. For eksempel har HF-molekylet en markant forskjell i elektronegativitet, ettersom fluor tiltrekker seg mye mer enn hydrogen, elektronparet i bindingen. Dermed er ikke fordelingen av ladninger symmetrisk, med elektriske dipoler.
Denne dipolen er representert av en vektor som vender mot enden som konsentrerer flest elektroner, det vil si fra det minste til det mest elektronegative atomet. Så i dette tilfellet vil vektoren, som er den eneste, være den resulterende vektoren, som angitt nedenfor:
Merk at vektorverdien er den samme som dipolmomentet, som er gitt i avskjedenhet (D = 3,33. 10-30 coulomb. T-bane). Siden dipolmomentet ikke er null, er molekylet og bindingen det polar.
Ikke stopp nå... Det er mer etter annonseringen;)
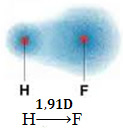
I molekylet nedenfor har vi også et molekyl med bare to atomer, men i dette tilfellet tilsvarer det et enkelt stoff, det vil si at det bare er dannet av en type element. Derfor er det ingen elektronegativitetsforskjell; atomer tiltrekker seg også elektroner, som er symmetrisk fordelt. Det resulterende dipolmomentet er lik null, så både bindingen og molekylet er apolar.
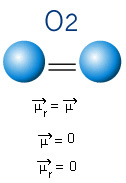
2) Molekylgeometridet vil si det romlige arrangementet av vektorene. BF-molekylet3 den har tre polare bindinger, hvor fluor er den mest elektronegative, og har dermed vektorene rettet mot den. Siden det romlige arrangementet av atomene er trigonal flatt, gjør dette imidlertid at elektronene har en symmetrisk fordeling rundt det sentrale atomet. Dermed er resultatet at disse tre vektorene avbryter hverandre og dipolmomentet er lik null. Derfor BF-molekylet3 é beklager.
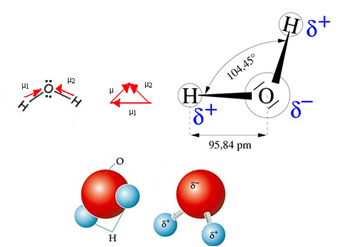
Vannmolekylet har to vektorer, men dens romlige geometri er ikke flat, men i form av en V. Legg merke til i følgende figur at på denne måten deres vektorer ikke avbryter hverandre, blir elektronene distribuert asymmetrisk og mer konsentrert i det mest elektronegative atomet, som er oksygen. Dermed er dipolmomentet forskjellig fra null, og vannmolekylet er det polar:
Av Jennifer Fogaça
Uteksamen i kjemi


