DE auto-oksi-reduksjon eller uforholdsmessig reaksjon er en type redoksreaksjon der det samme kjemiske elementet gjennomgår oksidasjon og reduksjon. La oss se på to eksempler på denne typen reaksjoner og hvordan vi skal balansere dem ved hjelp av redox-metoden:
Første eksempel:
PÅ2- + H+ → NEI3- + NO + H2O
- Ved å beregne oksidasjonstallene (NOX) for alle atomer og ioner som er involvert i reaksjonen, er det mulig å verifisere hvem som oksiderte og hvem som reagerte:
+3 -2 +1 +5 -2 +2 -2 +1 -2
PÅ2- + H+ → NEI3- + NO + H2O
- Merk at nitrogen var arten som både reagerte og oksiderte:
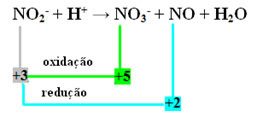
- For å balansere denne reaksjonen ved redoks, må vi relatere NOX til produktene, ikke reagensene:
PÅ3- = ∆Nox = 5 - 3 = 2
NO = ∆Nox = 3 - 2 = 1
- Inverterer ∆NOX med koeffisientene, har vi:
PÅ3- = ∆NOX = 2 → 2 vil være koeffisienten til NO
NO = ∆NOX = 1→ 1 vil være koeffisienten til NO3-
PÅ2- + H+ → 1 PÅ3- + 2 NO + H2O
- Med dette vet vi allerede at det er 3 N i produktet, så koeffisienten til NO2- blir 3:
3 NEI2- + H+ → 1 NEI3- + 2 NO + H2O
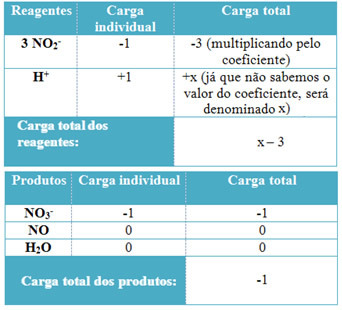
- For å bestemme koeffisientene til H+ og fra H2O, husk at antall mottatte elektroner tilsvarer samme mengde donerte elektroner; reagensladningen vil således være lik produktladningen. På denne måten kan vi lage følgende skjema:
Ikke stopp nå... Det er mer etter annonseringen;)
Basert på denne informasjonen har vi at den totale ladningen av reagensene er lik x - 3 og produktet er lik -1. Anklagene til de to må som sagt være like. Siden vi allerede har den totale belastningen på produkter, kan vi utføre en enkel beregning for å vite hva verdien av x vil være:
x -3 = -1
x = -1 +3
x = 2
Dermed er koeffisienten til H+ er 2 og følgelig den av H2Det blir 1:
3 NEI2- + 2 H+ → 1 NEI3- + 2 NO + 1 H2O
Andre eksempel:
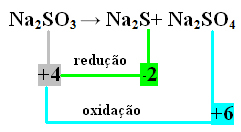
I dette tilfellet var det S som gjennomgikk reduksjon og oksidasjon samtidig. Således, som tidligere gjort, kan vi relatere NOX til produktene og invertere deres verdier ved å tildele koeffisientene til dem:
På2 S = ∆Nox = 4 - (-2) = 6 → 6 vil være koeffisienten til Na2 KUN4
På2 KUN4= ∆Nox = 6-4 = 2 → 2 vil være koeffisienten til Na2 s
På2 KUN3→ 2 På2 Y + 6 På2 KUN4
Siden det er 8 svovler i 2. lem, er Na-koeffisienten2 KUN3 blir 8:
8 inn2 KUN3→ 2 In2 S + 6 inn2 KUN4
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Selvoksidasjonsreaksjoner"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm. Tilgang 28. juni 2021.