DE saltbro ble foreslått av den engelske kjemikeren Frederic Daniell, i 1836, da denne lærde opprettet batteri oppkalt etter ham (Danill's Pile). denne broen er et U-formet rør som har to porøse ender. (bestående av bomull eller agar-agar) og inneholder en vandig løsning dannet av vann og et salt. Den forbinder indirekte løsningene til de to halvcellene i cellen (anoden og katoden).
Observasjon: Anoden er den negative polen på batteriet og er der oksidasjon oppstår, og katoden er den positive polen og hvor reduksjon oppstår.
For å forstå viktigheten av saltbroen er det i utgangspunktet nødvendig å forstå hvordan stabelen fungerer. Se diagrammet nedenfor:
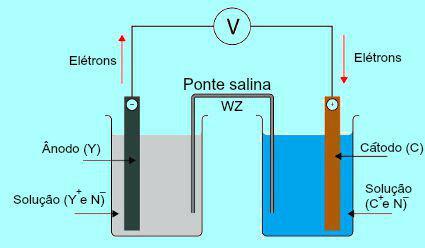
Generell skjema for en Daniell-stabel
Opprinnelig gjennomgår metallet (Y) av platen som er tilstede i anoden oksidasjon. Når man gjennomgår oksidasjon, blir metallet til kation, som faller inn i løsningen der platen er. Av denne grunn begynner anodeløsningen å presentere en høyere konsentrasjon av kationer (Y+). I dette tilfellet observeres en reduksjon i anodemetallplaten.
Y → og- + Y+
Deretter beveger elektronene som går tapt under oksydasjonen av metoden til anodeplaten, gjennom den eksterne elektriske ledningen og går til metallplaten som er tilstede i katoden. Dermed blir platen tilstede ved katoden ladet med elektroner.
-
De nåværende kationene (C+) i løsningen bevege seg mot katodeplaten fordi den er ladet med elektroner. Når kationene får elektronene som er tilstede i platen, blir kationene nøytrale (stabile og solide) og fester seg til den. Av denne grunn presenterer katodeoppløsningen en høyere konsentrasjon av anioner enn av kationer. I dette tilfellet observeres en økning i størrelse på katodemetallplaten.
Ikke stopp nå... Det er mer etter annonseringen;)
Ç+ + og- → C
Fra forståelsen av hvordan Daniels bunkeer det mulig å observere at løsningen i anoden mottar en større mengde Y-kationer+ på grunn av oksidasjonen av metallet på X-platen. Løsningen i katoden mister derimot kationene (C+) fordi de lider av reduksjon i plakk.
Det er nettopp i denne saken at arbeidet med saltbroen blir belyst. Hovedfunksjonen til denne broen er å fremme ladningsbalansen i både anode- og katodeløsninger. I saltbroen har vi alltid et salt (vanligvis kaliumklorid eller ammoniumnitrat.) Dissosiert i vann. Se representasjonen av en ligning i saltbroen:
WZ + H2O → W+ + Z-
I saltbroen er det to ioner (W+ og Z-), som forskyves til katoden og anoden i henhold til:
De) Anoden mottar anionene (Z-) tilstede i saltbroen på grunn av oksidasjonen av elementet (Y), som forårsaker en økning i mengden kationer (Y+) i løsningen.
B) Katoden mottar kationer (W.+saltbroen fordi kationen (C. under batteridrift)+) til stede i løsningen reduseres på tavlen. Dermed har katodeoppløsningen en større mengde anioner (N-) og mottar derfor kationen til stede i saltbroen.
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Seilbro"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Tilgang 28. juni 2021.


