Siden eldgamle tider har mennesket vært interessert i å svare på spørsmålet om materiens sammensetning.
Flere personligheter fra det vitenskapelige samfunnet tok stilling til emnet, men det var først på slutten av 1800-tallet at mysteriene om atomsammensetningen begynte å bli oppløst.
Den gamle filosofen Leucippus mente for eksempel at atomet var sammensatt av små partikler.
Etter denne definisjonen ble det foreslått av Democritus og Dalton at atompartikler var massive og udelbare.
Dette faktum ble senere omstridt av Thomson, en engelsk fysiker som oppdaget eksistensen av elektronet og da var i stand til å bekrefte ideen som tidligere ble foreslått av Leucipo.
Etter denne oppdagelsen presenterte Thomson en modell der atomet ble dannet av en sfære med positive ladninger og inne i kjernen var det elektroner.
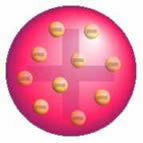
Thomsons Atom Model - I en positivt ladet, jevnt fordelt massesfære,
de ville være omgitt av negativt ladede elektroner, som i en pudding.
Selv etter Thomsons teori hadde atommodellen fortsatt en teoretisk-eksperimentell mangel som var i stand til å bevise at den var sann.
Emnet ble igjen diskutert varmt da fysikeren Rutherfords team bemerket at det var et veldig stort avvik (og uforklarlig, ifølge rosinpuddingsteorien) når noen radioaktive alfapartikler passerte gjennom et tynt lag med lamina metallisk.
Etter å ha analysert og studert faktum, kom Rutherford til den konklusjonen at atomradiusen er 10 000 ganger større enn radiusen til kjernen.
Gjennom hele studiet av atomet kom Rutherford og teamet hans, i 1911, til en atommodell, som de kalte atommodellen.

I 1913 dechifrerte Niels Bohr atommodellen og brukte kvantum av handling oppdaget av Planck i sine studier. Handlingskvantumet var faktisk det store jokertegnet som ville komme for å fullføre og avklare atommodellen.
Bohr justerte effektivt og enkelt modellen presentert av Rutherford og nådde følgende konklusjon:
Elektronen tilegner seg energi, som er representert gjennom en definert bane. De tillatte banene danner energinivåene.

Av Talita A. engler
Uteksamen i fysikk
Brasil skolelag
Fysikk Moderne - Fysikk - Brasilskolen
Kilde: Brasilskolen - https://brasilescola.uol.com.br/fisica/do-atomo-rutherford-ao-atomo-bohr.htm

