Hydrogenering skjer med umettede asykliske hydrokarboner, det vil si som har åpne kjeder med dobbelt- eller trippelbindinger, slik som alkener, alkyner og diener. Det kan også forekomme i aromatiske hydrokarboner, da de har dobbeltbindinger i ringen, og med syklaner (cykloalkaner) på opptil fem karbonatomer.
Disse forbindelsene reagerer som hydrogengass i nærvær av en eller annen katalysator, så som nikkel, platina og palladium, under oppvarming. Dermed oppstår en addisjonsreaksjon, der pi (π) bindingen brytes, og danner to nye enkeltbindinger og hydrogen blir introdusert i molekylet.
Generelt sett har vi:
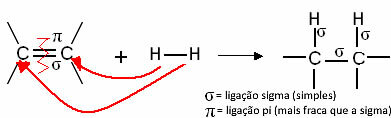
Generisk hydrogeneringsreaksjon
La oss nå se på noen eksempler:
- Hydrogenering til alkener: Det erholdte produktet er et alkan.
Nedenfor har vi en hydrogeneringsreaksjon av etylen (eller etylen) for å oppnå etan:
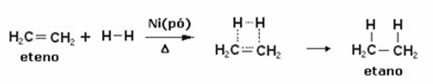
Eksempel på en etylenhydrogeneringsreaksjon
Denne typen katalytisk hydrogenering brukes av næringsmiddelindustrien til å lage halvfaste fettstoffer som margariner. Vegetabilske oljer og fett skiller seg bare ut ved at oljer har lange molekyler med dobbeltbindinger mellom karbon, mens fett bare har enkeltbindinger mellom seg karbon.
For å omdanne en olje til et fett er det således nok å hydrogenere oljen. På den måten blir dobbeltobligasjonene dine brutt og konvertert til enkeltobligasjoner. Resultatet er produksjon av samtaler hydrogenerte vegetabilske fettstoffer.
- Alkyne-hydrogenering: Siden alkyner har to pi-bindinger, skjer deres fullstendige hydrogenering i to trinn, i det første dannes et alken og i det andre en alkan.
I reaksjonen nedenfor har vi hydrogenering av propyn med endelig dannelse av propan:
Første trinn: H3C C ≡ CH + H2 → H3C CH═ ÇH2
2. etappe: H3C CH═ ÇH2 + 2 timer2 → H3C CH2─ ÇH3
Hvis vi vil at denne reaksjonen skal stoppe i første trinn, må vi bruke noe stoff som stopper katalysatorens handling.
- Hydrogenering av diener: Det er tre typer diener: akkumulert (dobbeltbindinger vises nedenfor), isolert (dobbeltbindinger er atskilt med minst to enkeltbindinger) og konjugater (dobbeltbindinger vises vekselvis).
Hydrogeneringen av akkumulerte og isolerte diener skjer på samme måte som vi så for alkener, men i dobbelt, da diener har mer umettethet. Se to eksempler:
* Eksempel på hydrogenering i akkumulert dien:
H H H
│ │ │
H3C CH ═ Ç ═ CH ─ CH3 + 2 timer2 → H3C CH ─ Ç ─ CH ─ CH3
│ │ │
H H H
* Eksempel på hydrogenering i isolert dien:
H H H H
│ │ │ │
H3C CH ═ CH─CH2 ─ CH ═ CH ─ CH3 +2 H2 → H3C CH ─ CH─CH2 ─ CH ─ CH ─ CH3
På den annen side kan hydrogenering av konjugerte diener skje på to måter: med 1,2 tilsetning og 1,4 tilsetning. Den vanligste er 1,2-tilsetningen, der hydrogen tilsettes karbon som danner dobbeltbinding og ved lave temperaturer. 1,4-tilsetningen skjer derimot ved forhøyede temperaturer og er når det er resonans og utseende av frie valenser i karbon 1 og 4. Se eksempler på hvert tilfelle:
* Eksempel på 1,2 tilsetning i konjugerte diener:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ─ C ─ CH CH2
│ │
H H
* Eksempel på tilsetning 1.4 i konjugerte diener:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ═ CH CH2
│ │
H H
- Hydrogenering av aromater: Pi-bindingene til benzenringen brytes, og hydrogenatomene tilsettes karbonene som lager disse bindingene.
Denne typen total hydrogenering er vist nedenfor:

Total benzenhydrogeneringsreaksjon
- Syklanhydrogenering: Dannelse av et alkan forekommer.
Eksempel: Hydrogenering av cyklopropan:
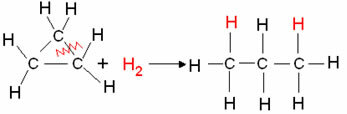
Syklopropanhydreringsreaksjon
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm