Til klassifiser en sigma-lenke, det er viktig å vite hvordan man gjenkjenner det i strukturen til et molekyl. Sigma-bindingen er faktisk en kovalent binding som oppstår når to ufullstendige atomorbitaler (med bare ett elektron) interpenetrere på samme akse. Et eksempel er når en p-type (helix) bane interpenetrerer med en annen p-orbital.

p-orbitaler som penetrerer i en p-p sigma-binding
I praksis (i øvelser), gjenkjenning og klassifisering av en sigma-kobling er laget av strukturformelen av et stoff, som i den strukturelle representasjonen nedenfor:

Strukturformel av hydrocyansyre
Før du klassifiserer en sigma-lenke, det er nødvendig å vite hvordan man gjenkjenner det i en strukturformel. For dette, bare husk måter som en kovalent binding er representert: samtalen enkel er representert av et enkelt bindestrek (-), par er representert av to (=) og lenken trippel er representert av tre (≡). Sigma-bindingen er til stede i en av de tre representasjonene av kovalente bindinger som følger:
Enkel: har et sigma-bånd;
Par: Av de to lenkene er bare en sigma;
Trippel: En av de tre koblingene er sigma.
Å vite hvordan du gjenkjenner en sigma-kobling, er neste trinn å lære å rangere den. For dette må vi vite hva som er den ufullstendige banen til hvert atom som er involvert i bindingen:
H - presenterer den ufullstendige s orbital, slik at den i klassifiseringen er representert med s.
Ametaler- ha en ufullstendig p-bane, så i klassifiseringen er de representert av p, med unntak av følgende elementer:
Karbon: Din ufullstendige bane avhenger av typen hybridisering at han lider. Mulighetene er: sp hybridisering3 (hvor mye koster det fire enkle samtaler), sp2 (hvor mye tjener det to enkelt- og en dobbeltbinding) eller sp (hvor mye det utfører to dobbeltbindinger eller en enkelt og en trippel). I klassifiseringen av en sigma-binding kan karbon således representeres av sp3, sp2 eller sp avhengig av samtalen du ringer.
Beryllium:lide sp-type hybridisering, således, i klassifiseringen, er representert av sp.
Bor:lide sp-type hybridisering2, således, i klassifiseringen, er den representert av sp.2.
Med all denne informasjonen er det enkleste å klassifisere sigma-koblingene i en struktur. La oss se noen eksempler:
Eksempel 1: sigmaforbindelser i vann

Strukturell formel for vann
Strukturformelen ovenfor viser at vann har to sigma obligasjoner (to enkle), er de mellom oksygenet (representert av s) det er Hydrogen (representert av s). Dermed har vi to sigma-lenker klassifisert i:
s-s
Eksempel 2: Sigma binder seg i fosfor triklorid

Strukturformel av fosfor triklorid
Strukturformelen ovenfor viser at fosfortriklorid har tre samtalersigmas (tre enkle), er de gå inn i fosfor (representert av s) det er klor (representert av s). Dermed har vi tre sigma-lenker klassifisert i:
p-p
Eksempel 3: sigma bindinger i bortrifluorid
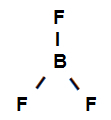
Strukturformel av bortrifluorid
Strukturformelen ovenfor viser at bortrifluorid har tre sigma lenker (tre enkle), er de gå inn i boret (representert av sp2) det er Fluor (representert av s). Dermed har vi tre sigma-lenker klassifisert i:
p-sp2
Eksempel 4: sigma obligasjoner i etanol
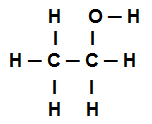
Etanol strukturformel
Strukturformelen for etanol ovenfor viser at vi har tilstedeværelse av åtte samtaler sigmas (åtte enkle lenker). Er de:
En blant Oxygen (representert av p) og hydrogenet (representert av s). Dermed blir lenken klassifisert i sigma s-p.
Ett av to karbonatomer som bare utfører sigmaforbindelser (og deretter representert av sp3). Dermed er lenken klassifisert i sp3-P3.
En blant karbonene (representert av sp3) og oksygen (representert av s). Dermed er sigma-lenken klassifisert i p-sp3.
fem mellom karbon (representert av sp3) og hydrogenet (representert av s). Dermed klassifiseres alle fem i s-sp3.
Eksempel 5: Sigma binder seg i dikloreten

Dikloreten strukturformel
Strukturformelen til dikloreten ovenfor viser at vi har nærvær av fem sigma lenker (de fire enkeltbindingene og en av dobbeltbindingene). Er de:
Ett av to karbonatomer som utfører to enkelt- og en dobbeltbinding (og deretter representert av sp2). Dermed er sigma-lenken klassifisert i sp2-P2.
Fire er mellom karbon(representert av sp2)og hydrogenet (representert ved s). Dermed er alle fire klassifisert i s-sp2.
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm
