På kjemiske bindinger er interaksjonene som oppstår mellom atomer for å bli et molekyl eller basisk substans av en forbindelse. Det er tre typer lenker: kovalente, metalliske og ionisk. Atomer søker, ved å lage en kjemisk binding, å stabilisere seg elektronisk. Denne prosessen forklares med oktettteori, som dikterer at hvert atom, for å oppnå stabilitet, må ha åtte elektroner i valensskallet.
Kjemiske obligasjoner og oktetregelen
DE søke etter elektronisk stabilitet, som rettferdiggjør realiseringen av kjemiske bindinger mellom atomer, forklares av oktettteori. Foreslått av Newton Lewis, sier denne teorien at atominteraksjonen skjer slik at hvert element får stabiliteten til en edelgass, det vil si åtte elektroner i valenssjikt.
For dette, elementet gi, motta eller dele elektroner fra det ytterste skallet, og danner derfor kjemiske bindinger av ionisk, kovalent eller metallisk karakter. Du edelgasser de er de eneste atomene som allerede har åtte elektroner i sitt ytterste skall, og det er derfor de ikke reagerer veldig mye med andre elementer.
Seogså: Elektroniske distribusjonsregler: hvordan gjør jeg det?
Typer kjemiske bindinger
For å få de åtte elektronene i valensskallet som forutsagt av oktettregelen, binder atomene seg sammen, som varierer i henhold til behovet for å donere, motta eller dele elektroner og også arten av bindingsatomer.
ioniske bindinger
Også kjent som elektrovalente eller heteropolare bindinger, skje mellom metaller og veldig elektronegative elementer (ametaler og hydrogen). I denne typen samtaler, metaller har en tendens til å miste elektroner, blir til kationer (positive ioner), og ikke-metaller og hydrogenforsterkningselektroner, blir anioner (negative ioner).
Du ioniske forbindelser er harde og sprø, har høyt kokepunkt og oppførsel elektrisk strøm når de er i flytende tilstand eller fortynnet med vann.
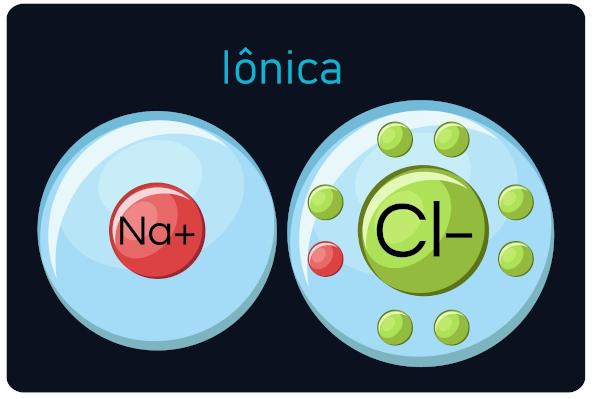
Observasjon: Vær oppmerksom på at atomet som får elektroner blir et ion med et negativt tegn, og at atomet som mister elektroner blir et positivt tegn.
Eksempler på ioniske stoffer:
- Bikarbonat (HCO3-);
- Ammonium (NH4+);
- Sulfat (SO4-).
For å lære mer om denne typen kjemisk binding, besøk vår tekst: ioniske bindinger.
kovalente bindinger
På kovalente bindinger skje av elektrondeling. På grunn av den lave elektronegativitetsforskjellen mellom bindingselementene, donerer eller mottar de ikke elektroner, men del elektroniske par slik at de er stabile i henhold til oktettregelen. Denne typen tilkobling er veldig vanlig i enkle elementer som Cl2, H2, O2, og også i karbonkjedene. forskjellen på elektronegativitet mellom ligandene bestemmer om bindingen er polær eller ikke-polær.

Les også:Polaritet av molekyler: hvordan identifisere?
dativ kovalent binding
Også kalt koordinere kovalent binding, semipolar, dativ eller koordinatbinding, det er veldig likt den kovalente bindingen, forskjellen mellom de to er at ett av atomene i dativbindingen er ansvarlig for å dele to elektroner. I denne typen tilkobling, det forekommer kunstig, får molekylet de samme egenskapene som et molekyl som skyldes en spontan kovalent binding.
Metalllenker
Denne typen binding skjer mellom metaller, som inkluderer elementene i 1A-familien (alkalimetaller), 2A (jordalkalimetaller) og overgangsmetallene (blokk B i det periodiske systemet - gruppe 3 til 12), og danner det vi kaller metalllegeringer. Differensialkarakteristikken i forhold til andre typer tilkoblinger er elektronbevegelse, som forklarer det faktum at metalliske materialer i solid tilstand er utmerkede elektriske og termiske ledere. I tillegg har metalliske legeringer høyt smelte- og kokepunkt, duktilitet, smidbarhet og glans. Eksempler på metalllegeringer er:
stål: jern (Fe) og karbon C;
bronse: kobber (Cu) + tinn (Sn);
messing: kobber (Cu) + sink (Zn);
gull: gull (Au) + kobber (Cu) eller sølv (Ag).

Sammendrag
- Kjemiske bindinger: samhandling mellom atomer som søker elektronisk stabilitet.
- Typer lenker: ionisk, kovalent og metallisk.
- Oktettregel: definerer at for at atomet skal være stabilt, må det ha åtte elektroner i valensskallet.
løste øvelser
Spørsmål 1 - (Mackenzie-SP) For at svovel- og kaliumatomer skal få en elektronisk konfigurasjon som er lik edelgass, er det nødvendig at:
(Data: atomnummer S = 16; K = 19).
a) svovel mottar 2 elektroner og kalium mottar 7 elektroner.
b) svovel gir 6 elektroner og kalium mottar 7 elektroner.
c) svovel gir 2 elektroner og kalium gir 1 elektron.
d) svovel mottar 6 elektroner og kalium gir opp 1 elektron.
e) svovel mottar 2 elektroner og kalium gir opp 1 elektron.
Vedtak
Alternativ E. Siden svovel er i 6A- eller 16-familien, og adlyder oktettregelen, må den skaffe 2 elektroner for å ha 8 i valensskallet. Kalium, derimot, som tilhører den første familien av det periodiske systemet (1A eller hydrogenfamilie), som i valenslaget har konfigurasjonen av en edelgass, trenger å miste 1 elektron. Ved å kombinere 2 kaliumatomer med 1 svovelatom, kan vi etablere en ionebinding der begge elementene er elektrisk stabile.
spørsmål 2 - (UFF) Brystmelk er en mat rik på organiske stoffer, som proteiner, fett og sukker, og mineralstoffer som kalsiumfosfat. Disse organiske forbindelsene har som hovedkarakteristikk de kovalente bindingene i dannelsen av molekylene, mens mineralet også har en ionisk binding. Sjekk alternativet som korrekt presenterer begrepene henholdsvis kovalente og ioniske bindinger:
a) Kovalent binding skjer bare i organiske forbindelser.
b) Kovalent binding gjøres ved elektronoverføring, og ionisk binding gjøres ved å dele elektroner med motsatte spinn.
c) Den kovalente bindingen dannes ved tiltrekning av ladninger mellom atomer, og den ioniske bindingen dannes ved ladningsseparasjon.
d) Den kovalente bindingen dannes ved å forbinde atomer i molekyler, og den ioniske bindingen, ved å forbinde atomer i kjemiske komplekser.
e) Kovalent binding gjøres ved å dele elektroner, og ionebinding gjøres ved elektronoverføring.
Vedtak
Alternativ E.
La oss se på de andre:
- Alternativ til: feil som kovalente bindinger forekommer også i uorganiske forbindelser som CO2.
- Alternativ b: feil, da kovalente bindinger oppstår ved deling, og ioniske bindinger ved elektronoverføring.
- Alternativ c: Både kovalent binding og ionisk binding skjer gjennom behovet for å miste eller få elektroner, ikke gjennom elektrostatisk tiltrekning mellom kjernene.
- Alternativ d: Begge bindinger, både kovalente og ioniske, skjer gjennom foreningen av atomer i et molekyl.
spørsmål 3 - (PUC-MG) Gjennomgå tabellen, som viser egenskapene til tre stoffer, X, Y og Z, under omgivelsesforhold.
| Substans | Smeltetemperatur (c °) | elektrisk Strømføringsevne | Løselighet i vann |
| x | 146 | ingen |
løselig |
| y | 1600 | høy | uoppløselig |
| z | 800 | bare smeltet eller oppløst i vann | løselig |
Med tanke på denne informasjonen er det RIKTIG å si at stoffene X, Y og Z er henholdsvis:
a) ionisk, metallisk, molekylær.
b) molekylær, ionisk, metallisk.
c) molekylær, metallisk, ionisk.
d) ionisk, molekylær, metallisk.
Vedtak
Alternativ C.
Stoff X er molekylær, som molekylære bindinger, også kalt kovalenter, har et lavt kokepunkt, da forskjellen i elektronegativitet mellom ligandene ikke er veldig høy. Generelt har ikke kovalente forbindelser elektrisk ledningsevne, og løseligheten er variabel.
Vi kan gjenkjenne stoff Y som metallisk, ettersom metaller har høyt smeltepunkt, er utmerkede elektriske ledere og er uoppløselige i vann.
Til slutt er substans Z ionisk, da smeltepunktet er relativt høyt for dette stoffet, noe som er en konsekvens av det krystallinske arrangementet av molekylet. Når et ionisk stoff er oppløst i vann eller i flytende tilstand, har det frie ioner, noe som gjør det elektronledende og vannløselig.
Av Laysa Bernardes Marques
Kjemilærer
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/ligacoes-quimicas.htm
