I studiet av termologi kaller vi det adiabatiske transformasjoner de gassformede transformasjonene der det ikke er varmeutveksling med det ytre miljøet. Derfor er varmen null i den adiabatiske transformasjonen.
Q = 0
Hvis vi bruker den første loven om termodynamikk, har vi:
Q = ∆U + τ
∆U = - τ
Men hva betyr det at det ikke er varmeutveksling mellom det ytre miljøet? Det betyr at hvis en gassutvidelse skjer og gassen utfører en jobb på 300 J, gjør den det ikke hvis det er varmeutveksling med mediet, vil variasjonen av gassens indre energi være negativ, derfor vi vil ha:
∆U = - 300 J
Nå, hvis det er en reduksjon i gassens indre energi, kan vi si at det også var en reduksjon i gassens temperatur. Fra den generelle gassloven

vi kan si at hvis volumet øker og gastemperaturen synker, vil gasstrykket nødvendigvis også reduseres. Generelt sett kan vi si at det samme skjer med kompresjon, for hvis det er kompresjon, vil den indre energien til gassen øke, så trykket vil også øke.
Mind Map: Adiabatic Transformation
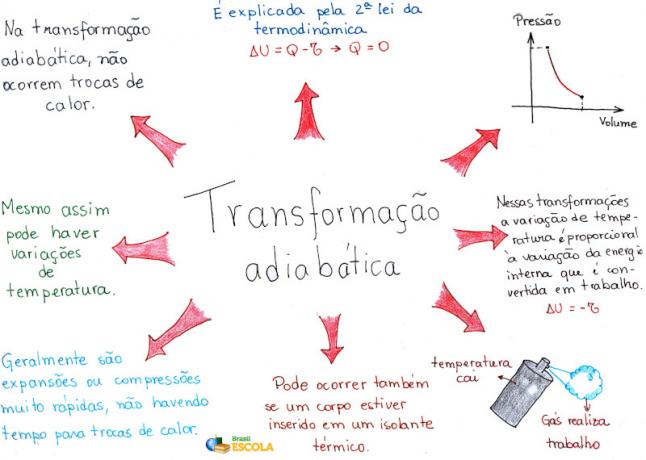
* For å laste ned tankekartet i PDF, Klikk her!
Kort sagt kan vi si at:
- i adiabatisk ekspansjon, reduseres temperatur og trykk;
- i adiabatisk kompresjon øker både temperatur og trykk.
Diagrammet nedenfor gir oss en oversikt over den adiabatiske transformasjonen:
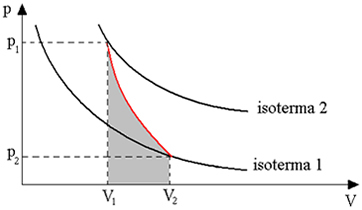
Adiabatiske transformasjoner oppnås ved bruk av termisk isolerte beholdere, eller også gjennom kompresjon eller veldig rask ekspansjon.
Dermed kan vi konkludere med at når en gass bytter varme med det ytre miljøet, tar det litt tid for varmen å forplante seg gjennom den gassformige massen og for at den kommer i likevekt. Derfor, når både ekspansjon og rask kompresjon utføres, er det praktisk talt ingen varmeveksling med det ytre miljøet.
* Mind Map av meg. Rafael Helerbrock
Av Domitiano Marques
Uteksamen i fysikk
Kilde: Brasilskolen - https://brasilescola.uol.com.br/fisica/estudo-transformacao-adiabatica.htm