Celler eller elektrokjemiske celler og batterier er enheter der kjemisk energi spontant blir transformert til elektrisk energi.Cellen består av bare to elektroder og en elektrolytt, mens batteriet er et sett med batterier i serie eller parallelt.
På primære batterier er ikke-oppladbare enheter, å være at når oksidasjonsreduksjonsreaksjonen som finner sted inne i dem opphører, må de kastes.
For hvert utstyr er det angitt en type batteri, og blant de primære batteriene som brukes for tiden, er de viktigste: Leclanché tørre celler (vanlige batterier eller syre celler), alkaliske batterier og litium / mangandioksid batterier.
Se hva som skiller dem ut og hvilket utstyr de passer til:
- Leclanché Dry Cells:
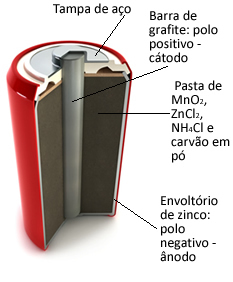
Disse haugene er i utgangspunktet dannet av en sinkhylle, atskilt med et porøst papir og en sentral grafittstang omgitt av mangandioksid (MnO2), pulverisert trekull (C) og en våt pasta som inneholder ammoniumklorid (NH4Cl), sinkklorid (ZnCl2) og vann (H2O).
O sink fungerer som anode, å miste elektroner; det er grafitt fungerer som katode, som leder elektroner til mangandioksid:
Anode Halvreaksjon: Zn (s) → Zn2+(her) + 2 og-
Katode-halvreaksjon: 2 MnO2 (aq) + 2 NH41+(her) + 2e- → 1 Mn2O3(s) + 2NH3 (g) + 1 time2O(1)
Global reaksjon: Zn (s) + 2 MnO2 (aq) + 2 NH41+(her) → Zn2+(her) + 1 Mn2O3 (r) + 2NH3 (g)
Denne typen batteri er egnet for utstyr som krever lett og kontinuerlig utladning, for eksempel fjernkontroll, veggklokke, bærbar radio og leker.
Du kan få mer informasjon om opprinnelse, funksjon, holdbarhet, ddp, farer og forholdsregler som må tas med disse batteriene i teksten “Leclanché Dry Stack”.
Ikke stopp nå... Det er mer etter annonseringen;)
- Alcaline-batterier:
Driften er veldig lik den for tørre celler i Leclanché, men den eneste forskjellen er den i stedet for klorid ammonium (som er et surt salt), tilsettes en sterk base, hovedsakelig natriumhydroksid (NaOH) eller kaliumhydroksid (KOH).
Anodehalvreaksjon: Zn + 2 OH → ZnO + H2O + 2e-
Katode-halvreaksjon: 2 MnO2 + H2O + 2e-→ Mn2O3 + 2 OH
Generell reaksjon: Zn +2 MnO2→ ZnO + Mn 2O3

Alkaliske batterier er mer fordelaktige enn syre i den forstand at de har større holdbarhet, i gir vanligvis 50-100% mer strøm enn et vanlig batteri av samme størrelse, pluss at det er mindre fare for lekkasjer.
De er hovedsakelig indikert for enheter som krever raske og mer intense nedlastinger, for eksempel radioer, bærbare CD / DVD- og MP3-spillere, lommelykter, digitale kameraer, etc.
Les også teksten Alcaline-batterier.
- Litium / mangandioksidbatterier:
Disse batteriene er lette og genererer en stor spenning (ca. 3,4 V), og det er derfor de ofte brukes i lite utstyr som klokker og kalkulatorer. I motsetning til tidligere tilfeller er formatet mynt, som vist på følgende bilde:

Anoden er litium, katoden er mangandioksid og elektrolytten er en saltoppløsning:
Anode halv reaksjon: lese →lese+ + og−
Katode halvreaksjon: MnO2 + lese+ + og−→MnO2(li)
Generell reaksjon: Li + MnO2 → MnO2(li)
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Vanligste typer celler og primære batterier"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Tilgang 27. juni 2021.


