En av de største utfordringene for alle som lærer kjemi kalles elektronisk distribusjon. Det vi skal presentere i denne sammenhengen kan i stor grad lette studiene dine knyttet til elektronkonfigurasjonen foreslått av forsker Linus Pauling.
Maksimalt antall elektroner som passer i hvert lag eller energinivå er gitt gjennom tabellen:
Energinivålag Maksimalt antall elektroner
1. K 2
2. L 8
3. M 18
4. N 32
5 ° O 32
6. P 18
7. Q 8
Den økende ordenen av energi på undernivåene er rekkefølgen i diagonalene. Linus Pauling-diagrammet er vist nedenfor:
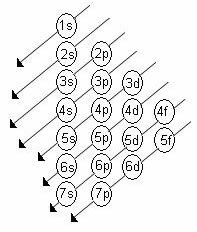
Grunnleggende regler:
1. Elementets atomnummer (Z), i nøytral tilstand, indikerer antall elektroner som skal distribueres. Dette tallet er representert i nedre venstre del av element-symbolet.
2. Bruk Pauling-diagrammet til å distribuere elektronene fra topp til bunn, og ta i betraktning den økende rekkefølgen av energi (orientert av pilens retning).
3. Fyll undernivåene med maksimalt nivå av elektroner. Hvis et gitt undernivå bare inneholder 6 elektroner, må du ikke overstige den mengden.
4. Kontroller antall elektroner ved å legge dem sammen i hvert undernivå.
La oss sette det i praksis?
Fordel elektronene til jernatomet (Z = 26).
Hvis atomnummeret er 26, betyr det at det i det normale jernatomet er 26 elektroner. Ved å bruke Pauling-diagrammet har vi:

Av Líria Alves
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm
