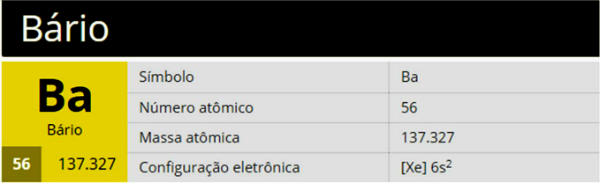
Barium er et kjemisk element med symbolet Ba, atomnummer 56 og atommasse 137,327, som tilhører gruppe 2 (familie 2A) i det periodiske systemet, som er et jordalkalimetall.
Navnet stammer fra gresk barys og det betyr tungt.
Funksjoner
Ved romtemperatur finnes den i fast tilstand, med en myk konsistens og en sølvfarget farge. Imidlertid finnes den ikke i sin rene form i naturen, da den lett oksyderes i kontakt med luft.
Barium finnes i barittmalm (BaSO4) og witherite (BaCO3). De viktigste gruveområdene for disse malmene forekommer i Storbritannia, Italia, Tsjekkia, USA og Tyskland.
Barium har høye smeltepunkter (1000 K - 727 ° C) og kokende (2170 K - 1897 ° C). Det er fortsatt en god leder av elektrisitet.
Det er veldig reaktivt i kontakt med vann og alkohol. Dens reaksjon med vann produserer hydroksid og frigjøres hydrogen.
Løselige bariumforbindelser er giftige for kroppen. Til tross for at det finnes i vann og mat, er ikke mengden barium som er tilstede nok til å forårsake helseproblemer.
På grunn av sin høye oksiderende kraft, må barium konserveres i mineralolje.
Lær mer, les også:
- Kjemiske elementer
- Periodiske tabell
applikasjoner
Blant de viktigste anvendelsene av barium er inkludert:
- I sin rene form brukes den til oksygenfjerning fra elektroniske ventiler;
- Rottegift, i form av bariumkarbonat;
- Brukes som et hvitt pigment i maling;
- Glassproduksjon;
- Bariumsulfat brukes som væske for boring av olje- og gassbrønner;
- Bariumklorat og nitrat brukes i produksjonen av grønne flammer i pyrotekniske bluss;
- Bariumsulfid forbedrer kontrasten for røntgenundersøkelser av fordøyelsessystemet og gis oralt til pasienter. Svelging forårsaker ikke helseproblemer, ettersom stoffet er uoppløselig, ikke akkumuleres og raskt blir eliminert fra kroppen;
Mens bariumsulfid er ufarlig, er bariumkarbonat ekstremt giftig og kan være dødelig. Personen med rus har pustevansker, oppkast, skjelving, takykardi, økt blodtrykk og salivasjon.
Du kan også være interessert i:
- Metalllenker
- Kobber
- Litium


