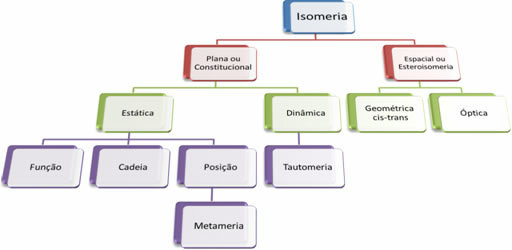
Siden det er tusenvis av organiske forbindelser, kan fenomenet isomeri ta flere former. Derfor kan isomerisme i utgangspunktet klassifiseres i to typer: flat eller konstitusjonell isomerisme og romisomerisme eller stereoisomerisme. Hver type nevnt kan deles inn, som vist i følgende diagram:
Se hvert tilfelle:
1. Flat eller konstitusjonell isomerisme: Isomerer av denne typen har samme molekylformel og er differensiert med flate strukturformler. Det er fem tilfeller av flyisomerisme: funksjon, kjede, posisjon, metamerisme og tautomeri.
1.1.Funksjonell eller funksjonell isomerisme: Forskjellen mellom isomerer er i den funksjonelle gruppen.
Eksempel: Molekylformel C3H6O
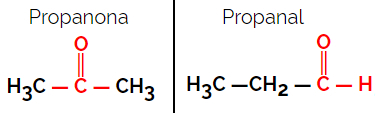
Merk at propanon er fra ketongruppen og propanal er fra aldehydgruppen.
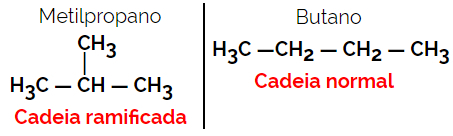
1.2. Kjede- eller skjelettisomerer: Forskjellen mellom isomerer er i typen kjede. For eksempel er den ene isomeren åpen og den andre lukket kjeden, eller den ene er normalkjedet og den andre forgrenet, eller den ene er en homogen kjede, og den andre er en heterogen kjede.
Eksempel: Molekylformel C4H10
1.3.Posisjonell eller posisjonell isomerisme: Forskjellen er i posisjonen til en umettethet, en funksjonell gruppe, et heteroatom eller en substituent.
Eksempel: Molekylformel C4H6

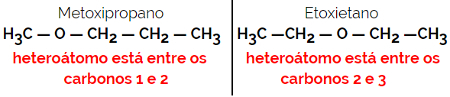
1.4.Kompensasjonsisomerisme eller metameri: Det er en spesiell type posisjonsisomerisme, der forskjellen er posisjonen til heteroatom.
Eksempel: Molekylformel C4H10O
1.5.Dynamic Isomery eller Tautomery: Det er en spesiell type funksjonsisomerisme, der isomerene eksisterer sammen i dynamisk likevekt i løsning. De to hovedtyper av tautomeria er mellom keton og enol (ketoenolbalanse) og mellom aldehyd og enol (aldoenolbalanse).
Eksempel: Molekylformel C3H6O
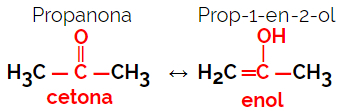
2. Romisomerisme eller steroisomerisme: I dette tilfellet kan forskjellen mellom isomerer bare visualiseres gjennom orienteringen av deres atomer i rommet. Det er to typer stereoisomerisme: geometrisk isomerisme og optisk isomerisme.
2.1.Geometriske eller cis-trans-isomerer: Forskjellen er at isomeren heter cis den har de samme karbonligandene i en dobbeltbinding eller i sykliske forbindelser på samme side av planet. Isomerligandene trans er på hver sin side.
Eksempel: Molekylformel C2H2Cl2

Disse forbindelsene kalles stereoisomerer.
2.2.Optisk isomer: Oppstår når isomerer er i stand til å avlede en stråle av polarisert lys. Hvis den bøyer den polariserte lysstrålen til venstre, er den en levorotær isomer, men hvis den bøyer seg mot høyre kalles den en høyrehendt isomer.
Eksempel:
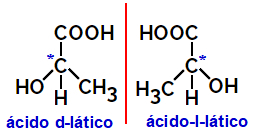
Asymmetriske molekyler som de som er vist ovenfor, som er speilbilder av hverandre og som ikke er overliggende, kalles enantiomerer.
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm