Energioksidasjon i alkyner er en organisk reaksjon som oppstår når en alkyn (et hydrokarbon som har en trippelbinding mellom to karbonatomer) tilsettes en sur løsning med reagens fra baeyer (Kaliumpermanganat - KMnO4).
MERK: En reaksjon av energi oksidasjon kan utføres med kaliumdikromat (K2Cr2O7), og ikke bare kaliumpermanganat.
Hver gang en reaksjon fra energisk oksidasjon i alkyner utføres, produktene som kan stamme er karboksylsyrer, vann (det eneste som vises i noen av dem) og karbondioksid (CO2).
Baeyer-reagens i surt medium
Når Baeyers reagens blandes med vann, i nærvær av en syre (stoff som kan frigjøre H-ioner+), er det dannelsen av to oksider (kaliumoksid og manganoksid II) og begynnende oksygener ([O]).

Mekanismer for energioksidasjon i alkyner
1. mekanisme: bryte trippelbåndet.
Opprinnelig angripes trippelbindingen av fremvoksende oksygener dannet av Baeyers reagens. Dette angrepet fører til at trippelbåndet blir fullstendig ødelagt.
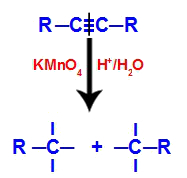
Forstyrrelse av trippelbindingen ved angrep av fremvoksende oksygener
Når trippelbindingen brytes, blir alkynen delt i to deler. På hvert av karbonene som var tredoblet, vises tre gratis valenser.
2. mekanisme: Interaksjon mellom hydroksylgrupper
Hver av de frie valensene på karbonene der trippelbindingen ble okkupert av hydroksylgrupper (OH), og danner en polyol (alkohol med flere hydroksyler).
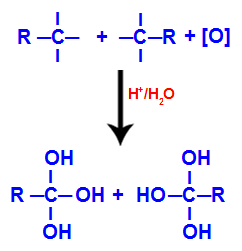
Dannelse av polyol med hydroksylgrupper etter tredobbelt spaltning
MERK: Hvis karbonet der den tredobbelte bindingen var, har et hydrogenatom festet til seg, vil det hydrogenatomet motta et begynnende oksygen og danne et annet hydroksyl.
3. mekanisme: Dannelse av vannmolekyler
Når et karbon har to eller flere OH-grupper, blir det en veldig ustabil struktur på grunn av tilstedeværelsen av ekstremt elektronegativer. På grunn av ustabilitet gjennomgår molekylet selvuttørking, det vil si at en hydroksyl binder seg til hydronium (H+) fra en annen hydroksyl og danner vann.

Dannelse av vannmolekyler fra to hydroksyler tilstede i den dannede polyolen
4. mekanisme: Produktdannelse
Etter dannelsen av vannmolekyler mister karbonet en binding på grunn av utgangen av a hydroksyl, og oksygenet til det andre hydroksylet mister også en binding som ble laget med en hydrogen. Derfor, mellom dette karbon og oksygen, vises en dobbeltbinding som danner en karbonyl (C = O) og stabiliserer begge deler.
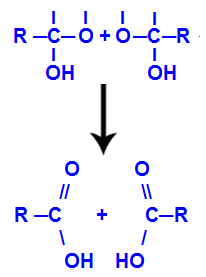
Karbonyldannelse i de to strukturene oppnådd fra alkyn
Eksempel på en Alkyne Energy Oxidation Equation
Eksempel: Energisk oksidasjon av But-1-ino
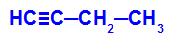
Strukturell formel for but-1-yne
Når but-1-yne plasseres i et medium som inneholder Bayers reagens, vann og syre, brytes bindingen. trippel eksisterende mellom karbon 1 og 2, på grunn av angrepet av de voksende oksygene som finnes i midten, som i ligningen nedenfor:
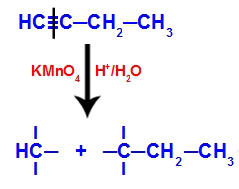
Brudd på but-1-yne-forbindelsene
Etter at trippelbindingen er brutt, mottar karbon 1 og 2 tre hydroksyler, men karbon 1 vil ha en til fordi den hadde et hydrogenatom (som binder seg til et voksende oksygen) og danner to polyoler (fragment 1 og 2).

Ligning som representerer dannelsen av polyoler
Like etterpå, da polyoler er ustabile, har vi dannelsen av vannmolekyler fra hydroksylene. I fragment 1 vises et vannmolekyl (fordi det er tre hydroksyler), og i fragment 2 vises to molekyler (fordi det er fire hydroksyler).
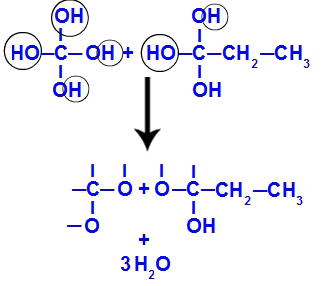
Dannelse av vannmolekyler fra but-1-yne fragmenter
Til slutt har vi dannelsen av dobbeltbindingen mellom karbonene som har mistet hydroksyl og oksygene som har mistet hydrogen, noe som gir opphav til karbonyler.

Dannelse av karbonyler i but-1-yne fragmentene
Med ligningen ovenfor kan vi se at but-1-yne ga opphav til karboksylsyre og karbondioksid (CO2).
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcinos.htm

