O atomradius (r) er vanligvis definert som halvparten av avstanden mellom to kjerner i nærliggende atomer, som figuren nedenfor representerer:

atomradius
Atomradien er forskjellig fra ett atom til et annet i henhold til familien og perioden på det periodiske systemet. Med hensyn til elementer som tilhører en samme familie, øker dets atomradius når atomnummeret øker., det vil si fra topp til bunn. For i denne forstand betyr det at fra et atom til et annet har et energinivå eller elektronisk lag økt, så radiusen øker proporsjonalt.
Med hensyn til elementet i samme periode, det vil si horisontalt, radiusen øker fra høyre til venstre, eller når atomnummeret synker. Dette er fordi de alle har like mange lag. Det som utgjør forskjellen er mengden av elektroner i disse lagene, og jo flere elektroner, jo større tiltrekning til kjernen, og dermed reduseres radiusen til atom.

Atomeradiusens vekstretning i henhold til familie og periode i det periodiske systemet
Atomeradien kan imidlertid variere avhengig av forbindelsen som opprettes. La oss se hvordan dette skjer:
* Ionic Bond: Hvis atomet danner en kation vil atomradiusen reduseres, siden å miste en eller flere elektroner, vil kjernen tiltrekke seg elektronene mer intenst. Nå hvis danne et anion, dvs. få elektroner, vil atomens radius øke, ettersom den totale ladningen til elektrosfæren vil være større enn den totale ladningen til kjernen, og redusere tiltrekningen. Jo flere elektroner du får eller mister, desto større blir variasjonen i strålens størrelse.
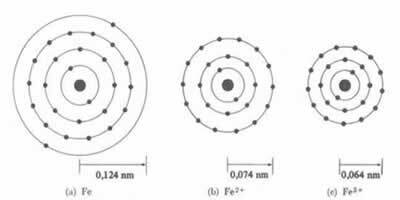
Kationens diameter eller radius er alltid mindre enn atomens diameter eller radius
Også i en serie med isoelektroniske ioner, som har samme mengde elektroner og energinivåer, vil ionet med minste atomnummer ha større radius. For eksempel ionene 13Al3+, 12mg2+, 11På1+, 9F-1, 8O2- og 7N-3, alle har 10 elektroner og 2 elektroniske nivåer. Men det som har den største radiusen er 7N-3, fordi den har det minste atomnummeret (Z = 7).
*Kovalent binding: Når to atomer lager en kovalent binding, hvis de to atomene er like, som i tilfelle hydrogengass (H2), man kan snakke om en kovalent radius (r), som er halvparten av bindingen (d), det vil si halve avstanden som skiller de to kjernene. Selv om, hvis bindingen er laget av forskjellige atomer, som i tilfelle av hydrogenklorid (HCl), lengden eller avstanden (d) vil være summen av de kovalente radiene (r1 + r2) av atomene som er involvert i kovalensen.
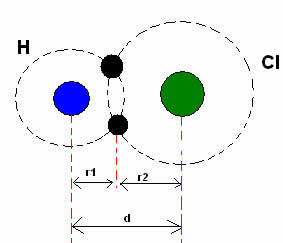
Summen av atomradier i en kovalent binding.
Selvfølgelig må vi huske at dette problemet er mye mer komplisert, ettersom den kovalente radiusen til et atom kan variere ettersom den binder seg til andre forskjellige atomer.
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm

