Hybridiseringsteorien dukket opp som et supplement til Oktettteori, klarer å forklare strukturen til et større antall molekyler, inkludert molekyler dannet av bor (B).
Dette elementet har fem grunntilstandselektroner, med følgende elektroniske konfigurasjon:
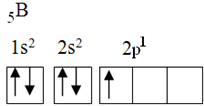
I følge oktetteorien kunne bor bare lage en kovalent binding, da den bare har en ufullstendig atombane. Eksperimentelt bemerkes det imidlertid at dette elementet danner forbindelser der det utfører mer enn en binding.
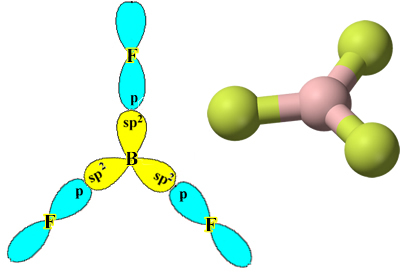
Et eksempel er bortrifluorid (BF3). Som vist nedenfor lager bor tre kovalente bindinger med fluor, og deler tre par elektroner og har seks elektroner i sitt siste skall (valenslag), dvs. et unntak fra regelen om oktett.
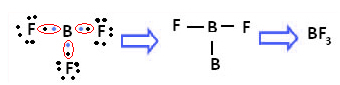
Dette forklares med hybridiseringsfenomenet som oppstår med bor. Det viser seg at et elektron fra undernivå 2s absorberer energi og går inn i den opphissede tilstanden, der det hopper inn i en tom bane av undernivå 2p. På denne måten dannes tre ufullstendige orbitaler, som nå kan lage tre kovalente bindinger:
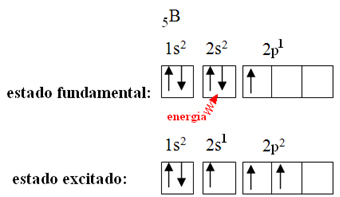
Imidlertid er bindingene dannet i bortrifluorid like, men hvis vi ser over, er det to bindinger annerledes, siden en av dem ville være laget ved hjelp av en s bane og de andre to ved hjelp av en bane av typen. skriv p. Det er her hybridiseringen finner sted, det vil si at de ufullstendige orbitalene smelter sammen og gir opphav til tre hybrid orbitaler eller hybridisert, som er identiske og forskjellige fra originalene:
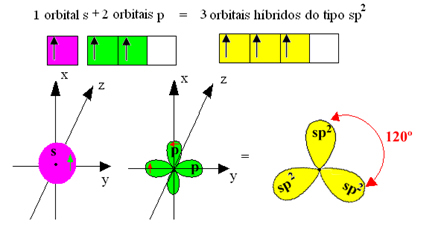
Siden disse hybridorbitalene består av en s orbital og to p orbitaler, kalles denne hybridiseringen sp² hybridisering.
Fluoren som binder seg til bor har ni elektroner. Dens elektroniske distribusjon og orbitaler er vist nedenfor:
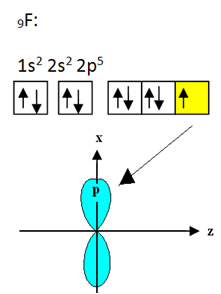
Vær oppmerksom på at hvert fluoratom bare kan lage en kovalent binding, og at banen som lager denne bindingen er av type p. Så følg nedenfor hvordan orbitalene dannes når du lager forbindelsene som danner BF3 og se hvordan lenkene er identiske σp-sp2:
Dette skjer også med andre elementer, se for eksempel teksten “Beryllium hybridisering”.
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm
