DEosmose og løsemiddelpassasje, fra en mindre konsentrert løsning til en mer konsentrert løsning, gjennom en semipermeabel membraninntil trykket som utøves av oppløsningen på membranen hindrer passasje av løsemiddel. Denne prosessen er ment å balansere konsentrasjonen av løsningen.
Les også: Oppløsningsmiddel og løsemiddel
osmotisk trykk
DE osmotisk trykk og trykk utøvd på løsningen med større konsentrasjon slik at osmose ikke oppstår, det vil si slik at løsningsmidlet ikke krysser den semipermeable membranen.
Osmotisk trykk brukes i prosesser av avsaltning av vann, tvinger prosessen med omvendt osmosehvorved løsningsmidlet passerer fra den mer konsentrerte løsningen til den mindre konsentrerte løsningen. Vi kaller denne prosessen omvendt osmose. Se følgende bilde som sammenligner de to prosessene:
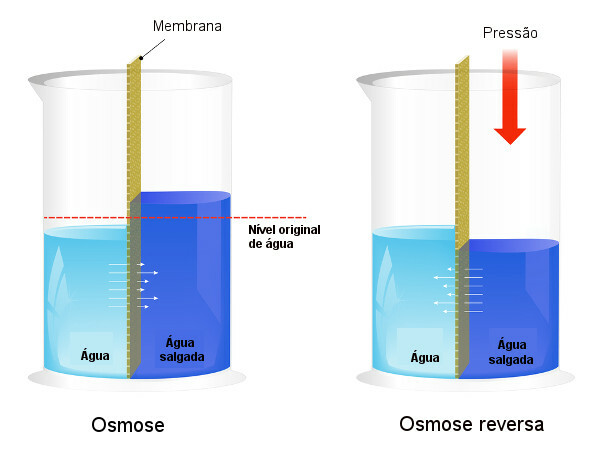
Legg merke til at passasjen av løsningsmiddel i osmose er i retning av den mest konsentrerte løsningen, og at, i omvendt osmose, er passasjen i motsatt retning på grunn av det påførte trykket. For å lære mer om emnet, les teksten vår:
osmotisk trykk.vite mer: Omvendt osmose i avsaltning av sjøvann
osmotisk trykkligning
Osmotisk trykk, representert ved bokstaven pi (π) av en løsning, kan beregnes ved hjelp av følgende ligning:
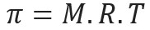
M = konsentrasjon i mol / L.
R = universell konstant av perfekte gasser
T = absolutt temperatur, i K
som andre kolligative egenskaper, det osmotiske trykket avhenger av løsningskonsentrasjondet vil si at jo større konsentrasjonen av løsningen er, jo større er effekten av osmose på løsningene, og jo større er det osmotiske trykket.
Eksempler
Osmose dukker opp i hverdagen til forskjellige tider. Vi kan nevne eksemplet på prosess for kjøttsalting til din bevaring. Du mikroorganismer som ville forårsake kjøttnedbrytning miste vannfra innsiden til utsiden, som har en konsentrasjon av salt, noe som får maten til å vare lenger.
På grunn av saltet hender det også at salatblader visner for å miste vann fra innsiden av deres celler (slags mindre konsentrert) for herdet løsning i det ytre miljøet.
Osmose er også viktig når vi snakker om blod menneskelig. Vi sier at den Røde celler og blodet er ett isotonisk medium, det vil si at de har samme osmotiske trykk, slik at det lett kan komme inn og ut av vann fra cellen.
Når blodet blir mindre konsentrert enn inne i de røde blodcellene (hypotonisk medium) vil passering av vann skje lettere inne i cellen, noe som gjør det hovne opp til sprengning. Hvis blodet når en konsentrasjon som er større enn konsentrasjonen av den røde cellen (hypertonisk medium), er blodceller visner, ettersom de mister vann.

Etter det samme prinsippet om kjøttbeskyttelse, er fruktbevaringi godterikompottene, som konserverer mat pga høy sukkerkonsentrasjon i løsningen.
Følgende er andre eksempler der osmose oppstår:
- i veksten av saft i anleggets ledende fartøy;
- kl hemodialyse;
- i selektiv passering av næringsstoffer i cellene i menneskekroppen.
For å forstå hvordan osmose skjer i dyrecellen, plantecellen og andre biologiske problemer, les: Osmose: hva det er og hvordan det forekommer i dyre- og plantecellen.
Av Victor Ferreira
Kjemilærer

