Vanligvis reaksjonene fra vandig elektrolyse og magmatisk elektrolyse de utføres med grafitt- og platinaelektroder, som ikke deltar i reaksjonen; de leder bare elektrisk strøm. Imidlertid er det noen spesifikke tilfeller der det er nødvendig å bruke aktive elektroder, det vil si som gjennomgår reduksjon og oksidasjon.
De viktigste brukssakene til disse elektrodene som deltar i redoks-prosessen er: a elektrolytisk metallrensing, slik som sink, kobolt, nikkel og spesielt kobber; og også galvanisering. La oss se hvordan hvert tilfelle oppstår:
• Elektrolytisk rensing av kobber: denne elektrolytiske kobberraffinering kan produsere en renhet på ca. 99,9% og brukes hovedsakelig til å lage kobberledninger som, hvis de har minst mulig urenhet, kan ha sin evne til å lede veldig elektrisk strøm redusert.
Observer hvordan denne prosessen foregår, se skjematisk av et elektrolytisk kar samlet nedenfor:

En potensiell forskjell påføres den vandige kobbersulfatløsningen (CuSo4 (aq)) - som leder elektrisitet - slik at anoden, som er et urent metallisk kobber, mister elektroner, det vil si den gjennomgår oksidasjon og frigjør kationene (Cu
2+), som er avsatt på den negative platen. Dette kan være en inert platina plate, eller, bedre, en ren kobber plate. Den utgjør katoden, som reduseres når kobber blir avsatt i den. Dermed er halvreaksjonene som oppstår i elektrodene: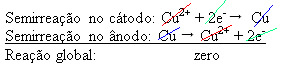
Det at det ga et nullresultat indikerer at det ikke var noen kjemisk reaksjon, men bare transport av kobber. Nederst i beholderen er de andre urene stoffene som var i kobber som gull, sølv, silisiumdioksyd (sand) og andre mineraler, som til og med kan selges.
• Galvanisering: et metallbelegg påføres et materiale som skal beskyttes mot korrosjon.
Metallet som er valgt for belegget - som kan være krom (forkroming), nikkel (nikkelbelegg), sølv (sølvbelegg), gull (forgylling) eller sink (galvanisering) - vil være den anode, positive elektroden, som gjennomgår oksidasjon og mister elektroner. Den gjennomgår oksidasjon i stedet for materialet som er beskyttet, fordi reduksjonspotensialet er større.
Den negative elektroden, det vil si katoden, som mottar disse elektronene og gjennomgår reduksjon, er selve materialet som ble belagt. På denne måten forblir den beskyttet selv om overflaten på en eller annen måte blir krenket.
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm

