Hvis det var mulig å visualisere strukturen til et metall veldig tydelig, ville vi se det som på bildet ovenfor. Atomstrukturen til metaller er krystallinsk, som består av metallkationer omgitt av elektroner.
De krystallinske gitterene som er tilstede i metaller kan fremstilles som følger: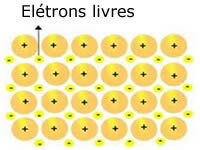
Representasjon av metallisk natrium (Na)
De krystallinske metallgitterene er dannet av en gruppe faste kationer.
Hver Na + -kation er omgitt av elektroner, men disse delokaliseres, det vil si at de ikke tiltrekkes av noen kjerne.
Siden det ikke er noen tiltrekning mellom negative ladninger (elektron) og den positive kjernen (kation), ender de frie elektronene opp med hele metallets krystallgitter. Friheten elektronene har til å bevege seg får dem til å danne en elektronisk sky.
Metallers evne til å lede elektrisitet forklares med tilstedeværelsen av denne skyen. Elektrisk strøm skyldes kontakt med frie elektroner med andre metaller.
I sammensetningen av ethvert atom, inkludert metaller som Sodium (Na), Gold Au, Copper (Cu), er det et valenslag. Elektroner beveger seg fritt gjennom dette laget og opprettholder den elektromagnetiske tiltrekningen for kationer. Denne strukturelle egenskapen tillater dannelse av metalliske molekyler og følgelig av metallene i seg selv.
Av Líria Alves
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm

