Jonisk binding skjer mellom ioner, som navnet antyder. Fordi de har motsatte ladninger, tiltrekker kationene (element med en positiv ladning) og anioner (element med en negativ ladning) hverandre elektrostatisk og danner bindingen. Imidlertid utgjør et ionisk fast stoff et agglomerat av kationer og anioner organisert med veldefinerte geometriske former, kalt gitter eller krystallinske gitter.
For eksempel dannes salt (natriumklorid) ved den definitive overføringen av et elektron fra natrium til klor, noe som gir natriumkation (Na+) og kloridanionet (Cl-). I praksis involverer denne reaksjonen ikke bare to atomer, men et enormt og ubestemt antall atomer som danner et kubikkformet krystallinsk gitter, som vist nedenfor:
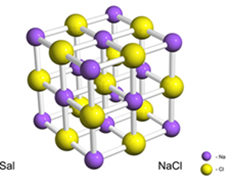
Hvis vi ser på saltkrystaller med et skanningelektronmikroskop, vil vi se at de faktisk er kubiske på grunn av deres indre struktur.

Siden hver ionisk forbindelse da består av et ubestemt og veldig stort antall ioner, hvordan kan vi representere en ionisk forbindelse?
Formelen som vanligvis brukes er
enhetsformel, som er den som representerer andelen uttrykt med minst mulig kationer og anioner som utgjør det krystallinske gitteret, slik at den totale ladningen av forbindelsen nøytraliseres. For at dette skal skje, er det nødvendig at antall elektroner som blir gitt opp av et atom er lik antall elektroner som mottas av det andre atomet.Noen aspekter ved enhetsformelen til ioniske forbindelser er viktige, se noen:
- Skriv alltid kationen først og deretter anionet;
- Siden hver ionisk forbindelse er elektrisk nøytral, trenger ikke de enkelte ioneladningene skrives ned;
- De underskrevne tallene som vises på høyre side av hvert ion indikerer forholdet mellom kationens atomer og anionet. Disse tallene kalles indekser og tallet 1 skrives ikke.
For eksempel, når det gjelder natriumklorid, har vi at enhetsformelen er NaCl, da vi har nøyaktig 1 natriumkation for hvert kloridanion.
Se et annet eksempel, Al3+ har tre positive ladninger, mens F- den har bare ett negativt, så det er nødvendig med tre fluoranioner for å nøytralisere forbindelsen. Dermed konkluderer vi med at enhetsformelen er AlF3.
En enkel måte å komme til enhetsformelen til den ioniske forbindelsen er å bytte ut ladningene mot indeksene, som vist på en generisk måte nedenfor:
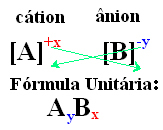
Eksempler:

En annen formel som brukes til å representere ioniske stoffer er Lewis formel eller elektronisk formel, hva representerer elektronene fra valensskallet til "ballene" -ionene rundt elementssymbolet. Når det gjelder salt, har vi:

Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm

