Syreoksider er de oksider som, når de reagerer med vann, produserer en syre som et produkt. Når du reagerer med en base, vil produktene være salt og vann.
Disse forbindelsene har vanligvis en kovalent karakter, det vil si at de er molekylære, oppløselige i vann og dannes hovedsakelig av ikke-metaller, som er grunnstoffer med høy elektronegativitet. Når de dannes av metaller, har disse høye oksidasjonstall (elektrisk ladning).
Eksempler:
CO2, KUN2, KUN3, P2O5, Cl2O6, PÅ2, Nei2O4, Nei2O5, etc.
Følgende er et generelt skjema for karakteristiske reaksjoner for syreoksider og et eksempel:
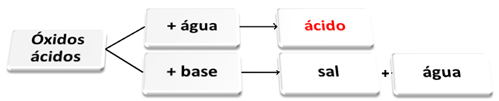
Syreoksider som reagerer med vann og med base
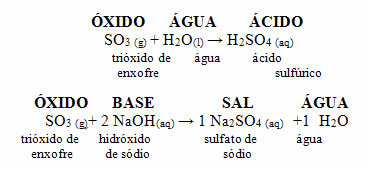
Syreoksider kalles også anhydrider, fordi dette ordet kommer fra gresk anhydros, som betyr "ingen vann"og syreoksider kan betraktes som en "vannfri syre".
Egenskaper og anvendelser av noen syreoksider:
• Karbondioksid (karbondioksid) - CO2:
Denne forbindelsen brukes som gass i brus og i mineralvann, fordi den blir løselig i vann når den utsettes for høyt trykk. Det produserer et surt medium i disse produktene, ettersom det er et surt oksid som reagerer med vann og produserer en syre i henhold til reaksjonen nedenfor:

Under 78 ° C er den i fast tilstand og er kjent som tørris, som får navnet sitt fordi det ser ut som is. vanlig, men den smelter ikke, overgår til flytende tilstand ved romtemperatur, men den går til damptilstand, det vil si den sublimer. Dermed brukes denne funksjonen som en naturskjønn ressurs i konserter, filmer, teatre, fester osv.

Karbondioksid er et syreoksid
Det finnes også i atmosfæren som et resultat av menneskelig åndedrett, forbrenning av fossile brensler (kull, petroleumsprodukter, alkohol, etc.) og skogbranner. Dermed er han en av de som er ansvarlige for surt regn.
• Svoveloksider - SO2 og så3
Disse oksidene er også til stede i atmosfæren, av naturlig og kunstig opprinnelse. Det naturlige skjer gjennom vulkanutbrudd og nedbrytning av planter og dyr. Det kunstige tilsvarer den største mengden av disse oksidene i atmosfæren, som de er utvist ved å forbrenne fossilt drivstoff, hovedsakelig dieselolje, som inneholder svovel som f.eks urenhet.
Svoveldioksid (SO2reagerer med oksygen fra atmosfæren og produserer svoveltrioksid (SO3). Når dette siste oksidet reagerer med regnvann, dannes svovelsyre som er veldig sterk og forårsaker skade.
• Brenning av svovel fra drivstoff: S + O2 → OS2
• Transformasjon av SO2 til SO3: SO2 + ½2 → OS3
Reaksjoner av SO2 og SO3 med vann som gir syrer: SO2 + H2O → H2KUN3
KUN3 + H2O → H2KUN4
• Dinitrogen tetroxides (salpetersalpetersyreanhydrid) - N2O4
Denne forbindelsen har et kokepunkt på 22 ° C, er gul i fargen og er ganske flyktig. Den dannes i atmosfæren ved oksidasjon av nitrogen og kan være i flytende form, i form av en dimer av mononitrogendioksid eller nitrogenoksid (NO2). Over den temperaturen tar den form av NO2:
N2O4 ↔ NEI2
Det er en ekstremt giftig gass, og innåndingen er dødelig. Det brukes også i sammensetningen av rakettdrivstoff.
Av Jennifer Fogaça
Uteksamen i kjemi
