Til periodiske tabellfamilier er de vertikale sekvensene av tabellen og samle kjemiske elementer med lignende kjemiske egenskaper. Slike likheter skyldes tilstedeværelsen av like mengder valenselektroner for elementene gruppert i samme familie. Familier rommer de representative elementene i gruppe 1 og 2, fra 13 til 18 og overgangselementene i gruppe 1 til 12.
Les også:Transuraniske elementer - de menneskeskapte kjemiske elementene som kommer etter uran i det periodiske systemet
Oppsummering av periodiske systemfamilier
Familiene tilsvarer de vertikale linjene til Periodiske tabell.
Også kjent som grupper, er familier i det periodiske systemet nummerert fra 1 til 18.
Kjemiske grunnstoffer i samme familie har lignende kjemiske egenskaper.
Kjennheten til et sett med elementer forklares ved å ha like mange valenselektroner.
De representative elementene er delt inn i gruppene 1, 2, 13, 14, 15, 16, 17 og 18. Hver av disse familiene har spesifikke navn.
Overgangselementene danner en enkelt familie som er delt inn i gruppene 3, 4, 5, 6, 7, 8, 9, 10, 11 og 12.
Organisering av periodiske systemfamilier
Familier i det periodiske system er de vertikale sekvensene til tabellen, altså kolonnene. Også kjent som grupper, familiene til det periodiske system er nummerert fra 1 til 18, fra venstre til høyre.
Kjemiske grunnstoffer som opptar samme kolonne anses å være i samme familie., på grunn av likheten mellom deres kjemiske egenskaper, som skyldes det faktum at de har samme antall elektroner på valens skall. For eksempel har alle kjemiske elementer i familie 18 åtte elektroner i valensskallet (fullt skall) og deltar sjelden i kjemiske bindinger.
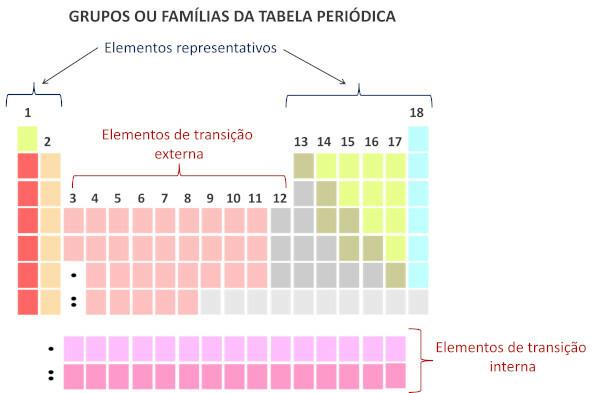
I henhold til det moderne systemet International Union of Pure and Applied Chemistry (Iupac), er hver gruppe eller familie identifisert med et tall fra 1 til 18, fra venstre til høyre i det periodiske systemet.
Det er viktig å fremheve at det gamle IUPAC-systemet tok i bruk et alfanumerisk system, med bokstavene A og B for å referere til henholdsvis representativt og overgangselementer. Foreløpig brukes ikke lenger denne typen nomenklatur.
Nomenklatur for periodiske systemfamilier
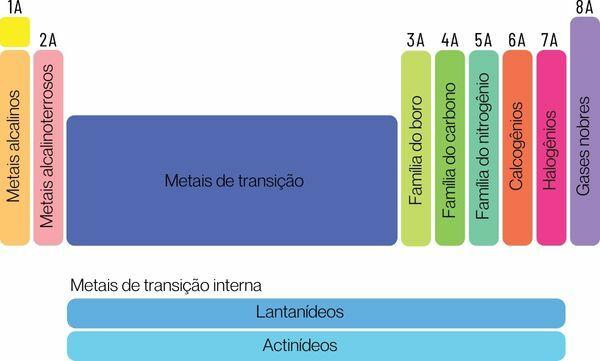
Kjemiske elementer kan klassifiseres i to store familier: representative elementer og overgangselementer.
→ Representative elementer i det periodiske system
De representative elementene er delt inn i gruppene 1, 2, 13, 14, 15, 16, 17 og 18. Hver av disse gruppene har et spesifikt navn, som det også kan kjennes under. Se:
Gruppe 1: familie av metaller alkalisk.
Gruppe 2: familie av jordalkalimetaller.
Gruppe 13: bor eller jordmetallfamilie.
Gruppe 14: karbonfamilie.
Gruppe 15: Nitrogen- eller Pnicogens-familien.
Gruppe 16: oksygen- eller kalkogenfamilie.
Gruppe 17: familie av halogener.
Gruppe 18: familie av edle gasser.
→ Overgangselementer i det periodiske system
Du overgangselementerdanne en enkelt familie delt inn i gruppene 3, 4, 5, 6, 7, 8, 9, 10, 11 og 12. Lantanid- og aktinidseriene er også en del av overgangselementene.
Overgangselementene er alle metalliske og har lignende kjemiske egenskaper, selv med forskjellige elektroner i valensskallet og ville derfor danne en enkelt og stor familie av overgangsmetaller.
Kjemiske grunnstoffer fra familiene til det periodiske system
Hver familie eller gruppe er sammensatt av et sett med kjemiske elementer. Se beskrivelsen av de kjemiske elementene som utgjør hver familie:
Gruppe 1:litium, natrium, kalium, rubidium, cesium, francium.
Gruppe 2:beryllium, magnesium, kalsium, strontium, barium, radio.
Gruppe 3:skandium, yttrium, lantanidserier og aktinidserier.
Gruppe 4: titan, zirkoniumoksidO, hafnium Det er rutherfordium.
Gruppe 5:vanadium, niob, tantal Det er dubnium.
Gruppe 6:krom, molybden, wolfram Det er seaborgium.
Gruppe 7:mangan, technetium, rhenium Det er bohrio.
Gruppe 8: jern, rutenium, osmium Det er hassium.
Gruppe 9:kobolt, rhodium, iridium og meitnerium.
Gruppe 10:nikkel, palladium, platina og darmstadtio.
Gruppe 11: kobber, sølv, gull og røntgenium.
Gruppe 12:sink, kadmium, Merkur og Copernicus.
Gruppe 13: bor, aluminium, gallium, indium og tallium.
Gruppe 14: karbon, silisium, germanium, tinn, lede og flerovium.
Gruppe 15:nitrogen, fosfor, arsenikk, antimon Det er vismut.
Gruppe 16:oksygen, svovel, selen, tellur, polonium og livermorium.
Gruppe 17: fluor, klor, brom, jod og astatin.
Gruppe 18:helium, neon, argon, krypton, xenon Det er radon.
Viktig: det kjemiske elementet hydrogen er et spesielt tilfelle, fordi til tross for at den ligger ved siden av gruppe 1, er den ikke en del av alkalimetallfamilien, siden den ikke deler lignende kjemiske egenskaper.
Vite mer: Hva er de radioaktive grunnstoffene i det periodiske systemet?
Hovedkarakteristika for familiene til det periodiske systemet
→ Gruppe 1 eller familie av alkalimetaller
De er metalliske faste stoffer, skinnende og glatte.
De har høy varmeledningsevne og høy Elektrisk ledningsevne.
ha temperaturer relativt lav smelting.
De er svært reaktive med vann.
Tendens til å danne monovalente kationer (ladning +1).
→ Gruppe 2 eller familie av jordalkalimetaller
De er metalliske faste stoffer, skinnende og hardere sammenlignet med alkalimetaller.
De oksiderer lett.
De har høy varmeledningsevne og høy elektrisk ledningsevne.
De har litt høyere smeltetemperaturer sammenlignet med alkalimetaller.
De er reaktive med vann.
Tendens til å danne toverdige kationer (ladning +2).
→ Gruppe 3 til 12 eller familie av overgangsmetaller
De er den største familien i det periodiske systemet.
Harde, skinnende metalliske faste stoffer.
De har høy varmeledningsevne og høy elektrisk ledningsevne.
Tett.
Høye smeltetemperaturer.
kan presentere annerledes oksidasjonstilstander.
→ Gruppe 13 eller borfamilie
De har mellomegenskaper mellom egenskapene til metaller og ikke metaller.
De er solide under omgivelsesforhold.
Tendens til å danne trivalente kationer (ladning +3).
→ Gruppe 14 eller karbonfamilie
De har mellomegenskaper mellom egenskapene til metaller og ikke-metaller.
De er solide under omgivelsesforhold.
Tendens til å danne fire bindinger.
De er solide under omgivelsesforhold.
Karbon og silisium kan danne kjedebindinger.
→ Gruppe 15 eller nitrogenfamilie
De har mellomegenskaper mellom egenskapene til metaller og ikke-metaller.
Faste stoffer under omgivelsesforhold, med unntak av nitrogen, som er en gass.
Nitrogen og fosfor er grunnleggende i levende organismer.
Arsen er svært giftig.
→ Gruppe 16 eller oksygenfamilie (kalkogener)
De har forskjellige egenskaper, og skifter fra ikke-metallisk til metallisk element etter hvert som du går nedover i familien.
Faste stoffer under omgivelsesforhold, med unntak av oksygen, som er en gass.
Tendens til å danne toverdige anioner (ladning -2).
→ Gruppe 17 eller familie av halogener
De er ikke-metaller.
Ganske reaktivt.
Dårlige termiske og elektriske ledere.
Under omgivelsesforhold eksisterer fluor og klor som gasser, brom er flytende og jod er fast.
Tendens til å danne monovalente anioner (ladning -1).
→ Gruppe 18 eller edelgassfamilie
De er ikke-metaller.
Svært lite reaktive, så de kan kalles inerte gasser.
De finnes i form av gasser.
De har ingen tendens til å dannes ioner.
Periodisk system og elektronisk distribusjon
Kjemiske grunnstoffer som tilhører samme familie eller gruppe har lignende kjemiske egenskaper fordi de har like mange elektroner i valensskallet.
Antall elektroner i valensskallet er relevant, da det bestemmer tendensen til dannelse av kationer eller anioner, typen kjemisk binding som skal dannes, energien involvert i kjemiske reaksjoner, blant annet kjennetegn. For å finne antall valenselektroner, det er nødvendig å kjenne til atomnummer av elementet og utføre din elektronisk distribusjon.
→ Elektronisk distribusjon av representative elementer
De representative elementene har sine mest energiske elektroner i undernivåer s Det er P av det elektroniske laget (n). Følgende tabell samler de elektroniske konfigurasjonene knyttet til hver familie av representative elementer. begrepet n varierer fra 1 til 7 og representerer energinivået okkupert av valenselektronene, tilsvarende perioden (horisontal linje) i det periodiske systemet der grunnstoffet er funnet.
Elektronisk distribusjon av representative elementer | ||
familie eller gruppe |
Elektronisk distribusjon |
Eksempel |
1 |
oss1 |
Li (Z=3): 1s2 2s1 |
2 |
oss2 |
Vær (Z=4): 1s2 2s2 |
13 |
oss2 np1 |
B (Z=5): 1 s2 2s22p1 |
14 |
oss2 np2 |
C (Z=6): 1 s2 2s22p2 |
15 |
oss2 np3 |
N (Z=7): 1s2 2s22p3 |
16 |
oss2 np4 |
O (Z=8): 1 s2 2s22p4 |
17 |
oss2 np5 |
F (Z=9): 1s2 2s22p5 |
18 |
oss2 np6 |
Ne (Z=10): 1s2 2s22p6 |
→ Elektronisk distribusjon av overgangselementer
Overgangselementene er fordelt på gruppe 3 og 12 og har undernivåene d Det er f okkupert av valenselektroner:
Eksterne overgangselementer: holde valenselektroner på undernivået d, holde elektronkonfigurasjonen lik oss2 (n-1)d(1 til 8). For eksempel tilhører elementet nikkel (Z = 28) gruppe 10, og dets konfigurasjon er 1s2 2s2 2p6 3s2 3 s6 4s2 3d8.
Interne overgangselementer: de er en del av gruppe 3, men er "interne" i det periodiske systemet, og utvides under det, i periode 6 (lantanider) og 7 (aktinider). Disse elementene har valenselektroner som okkuperer underskallet f og generell elektronisk konfigurasjon av oss2 (n-2)f(1 til 13). For eksempel er grunnstoffet lantan (Z = 57) det første elementet i lantanidserien, og elektronkonfigurasjonen er 1s2 2s2 2p6 3s2 3 s6 4s2 3d10 4 s6 5s2 4d10 5 s6 6s2 4f1.
Vet også:Hva er opprinnelsen til det periodiske systemet?
Løste øvelser om familiene til det periodiske system
Spørsmål 1
(UFC — tilpasset) Angående den moderne periodiske klassifiseringen av elementer, kryss av for den sanne setningen:
A) I det periodiske systemet tilsvarer familier eller grupper horisontale linjer.
B) Grunnstoffer i en familie har svært forskjellige kjemiske egenskaper.
C) I en familie har grunnstoffer generelt like mange elektroner i det siste skallet.
D) I en periode har grunnstoffene lignende kjemiske egenskaper.
E) De representative elementene er fordelt i gruppe 3 til 12.
Vedtak:
Alternativ C
Punkt A er feil: familiene eller gruppene er kolonnene (vertikale linjer) i det periodiske systemet.
Punkt B og D feil: I en familie har grunnstoffer lignende kjemiske egenskaper. I perioder har elementer det samme elektronskall okkupert av valenselektroner.
Punkt C riktig: I en familie har grunnstoffene like mange elektroner i det siste skallet.
Punkt E feil: representative elementer er gruppe 1, 2, 13, 14, 15, 16, 17 og 18. Overgangselementene er fordelt i gruppe 3 til 12.
spørsmål 2
(EAM) Elementene A, B og C har følgende elektronkonfigurasjoner i valensskallene:
A: 3s1
B: 4s2 4 s4
C: 3s2
Basert på denne informasjonen, velg riktig alternativ.
A) Grunnstoff A er et alkalimetall.
B) Element B er et halogen.
C) Grunnstoff C er et kalkogen.
D) Grunnstoffene A og B tilhører den tredje perioden av det periodiske system.
E) De tre grunnstoffene tilhører samme gruppe i det periodiske system.
Vedtak:
Alternativ A
Element A korrekt: element A har en elektronisk distribusjon som inneholder bare ett valenselektron, derfor tilhører det gruppe 1 i det periodiske systemet.
Feil element B: element B har en 4s elektronkonfigurasjon2 4 s4, som indikerer at det er 6 elektroner i det siste skallet og at dette grunnstoffet tilhører gruppe 16 (kalkogener).
Feil element C: element C har en elektronisk konfigurasjon med 2 elektroner i det siste skallet, så det er et element i gruppe 2 i tabellen.
Feil element D: element A tilhører den tredje perioden (n = 3), og element B tilhører den fjerde perioden (n = 4).
Feil element E: de tre grunnstoffene har forskjellige mengder elektroner i det siste skallet, så de kan ikke være en del av samme familie.
Av Ana Luiza Lorenzen Lima
Kjemilærer
Kilde: Brasil skole - https://brasilescola.uol.com.br/quimica/familias-da-tabela-periodica.htm
