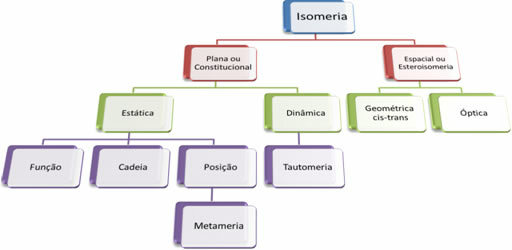
DE clapeyron-ligningen, også kjent som perfekt gasstilstandsligning eller enda generell gassligning, opprettet av den parisiske forskeren Benoit Paul Emile Clapeyron (1799-1864), er vist nedenfor:
til. V = n. EN. T
Være det:
p = gasstrykk;
V = gassvolum;
n = mengde stoff i gassen (i mol);
T = gasstemperatur, målt på kelvinskalaen;
R = universell konstant for perfekte gasser.
Men hvordan kom du frem til denne ligningen?
godt i teksten Generell gassligning, det er vist at når en fast masse av en gass gjennomgår transformasjon til dens tre grunnleggende størrelser, som er trykk, volum og temperatur, forblir forholdet nedenfor konstant:
tilførste. Vførste = tilEndelig. VEndelig
Tførste TEndelig
eller
til. V = konstant
T
Denne konstanten er imidlertid proporsjonal med mengden materie i gassen, så vi har:
til. V = n konstant
T
Når vi sender temperaturen til det andre medlemmet, har vi:
til. V = n. konstant. T
Dette er tilstandsligningen for perfekte gasser foreslått av Clapeyron.
Den italienske kjemikeren Amedeo Avogadro (1776-1856) beviste det
like volumer av alle gasser, som har samme temperatur- og trykkforhold, har samme antall molekyler. Og dermed, 1 føflekk av enhver gass har alltid samme mengde molekyler, som er 6,0. 1023 (antall Avogadro). Dette betyr at 1 føflekk av en hvilken som helst gass også alltid opptar det samme volumet, som under normale temperatur- og trykkforhold (CNTP), der trykket er lik 1 atm og temperaturen er 273 K (0°C), er lik 22,4L.Med disse dataene i hånden kan vi finne ut verdien av konstanten i ligningen ovenfor:
til. V = n. konstant. T
konstant = til. V
n. T
konstant = 1 atm. 22,4 L
1 mol. 273K
konstant = 0,082 atm. L. mol-1. K-1
Ikke stopp nå... Det er mer etter reklamen ;)
Dermed ble denne verdien definert som universell gasskonstant og det kom også til å bli symbolisert med bokstaven R.
Under forskjellige forhold har vi:
R = PV = 760 mmHg. 22,4 L = 62,3 mmHg. L/mol. K
nT 1 mol. 273,15K
R = PV = 760 mmHg. 22 400 ml = 62 300 mmHg. ml/mol. K
nT 1 mol. 273,15K
R = PV = 101 325 Pa. 0,0224 m3 = 8.309 Pa.m3/mol. K
nT 1 mol. 273,15K
R = PV = 100 000 Pa. 0,02271 m3 = 8.314 Pa.m3/mol. K
nT 1 mol. 273,15K
Vi kan deretter løse problemer som involverer gasser under ideelle forhold ved å bruke Clapeyron-ligningen, slik den gjelder for enhver type situasjon. Det er imidlertid viktig å understreke at man bør være nøye med enhetene som brukes til å bruke riktig verdi for den universelle gasskonstanten, R.
Videre, siden mengden materie kan bestemmes av formelen:
n = pasta → n = m
molar masse M
vi kan erstatte "n" i Clapeyron-ligningen og få en ny ligning som kan brukes i tilfeller der verdien av antall mol av gassen ikke er direkte gitt:
til. V = m . EN. TM
Av Jennifer Fogaça
Uteksaminert i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Statsligning for gasser (Clapeyron-ligning)"; Brasil skole. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/equacao-estado-dos-gases-equacao-clapeyron.htm. Åpnet 27. juli 2021.
Hva er gasser, hva er egenskapene til gasser, molekylære forbindelser, komprimerbarhet, fast volum, kinetisk energi gjennomsnittlig, absolutt temperatur på en gass, ideell gass, ekte gasser, perfekt gass, gasstilstandsvariabler, volum av en gass, årstider
Kjemi

Atmosfærisk trykk, forholdet mellom kraften som utøves på en gitt overflate, områder med stor høyde, minste mengde luftpartikler per volumenhet, Bolivia, Kina, Colombia, Ecuador, stater Forent.