Alkoholer kan gjennomgå oksidasjon når de utsettes for et oksidasjonsmiddel, for eksempel en vandig løsning av kaliumdikromat (K2Cr2O7) eller kaliumpermanganat (KMnO4) i et surt medium.
Et begynnende oksygen [O] i midten vil angripe karbonet knyttet til alkoholens funksjonelle gruppe (hydroksyl- OH), danner en veldig ustabil forbindelse, kalt tvillingdiol, som har to hydroksylgrupper knyttet til det samme karbon. Siden den er ustabil, frigjør denne forbindelsen vann og gir opphav til et nytt produkt.
Dette produktet vil avhenge av typen alkohol som har blitt oksidert, enten det er primær, sekundær, tertiær eller metanol.
Kort fortalt har vi:
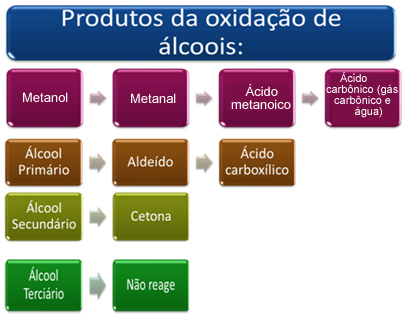
Se hver sak nedenfor:
- Metanol (H3C─ OH):
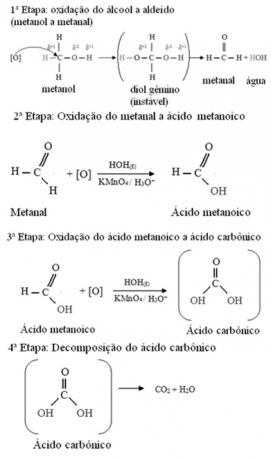
Metanol er den eneste alkoholen som har tre hydrogener bundet til karbon som vil gjennomgå oksidasjon. I dette tilfellet, siden det er tre punkter på molekylet som et begynnende oksygen kan angripe, vil tre påfølgende oksidasjoner forekomme, som vist i diagrammet nedenfor:
- Primære alkoholer:
I disse forbindelsene er hydroksylkarbonet bare knyttet til ett karbonatom, det vil si at de to andre ligandene er hydrogener, og det er to steder for det begynnende oksygenet å angripe.
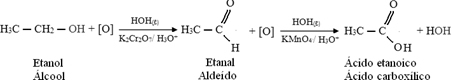
Først vil det være dannelsen av et aldehyd, som vist nedenfor:
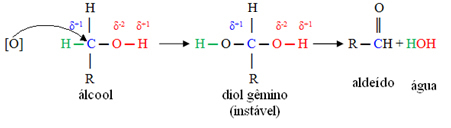
Men oksidasjonen fortsetter, fordi reagensene som brukes til å oksidere alkohol er sterkere enn de som brukes til å oksidere et aldehyd. Deretter angriper et annet begynnende oksygen karbonylkarbonet og produserer en karboksylsyre.
Følgende er et eksempel, oksidasjon av etanol, først til etanal og deretter til etansyre (eddiksyre). Denne totale reaksjonen er transformasjonen av vin til eddik.
Ikke stopp nå... Det er mer etter reklamen ;)
Delvis oksidasjon av etanol til etanal oppstår når en alkoholisert person tar en engangsalkotest. Inne i denne enheten er det en fast blanding av kaliumdikromat og silika i et surt medium, med følgende reaksjon:
K2Cr2O7(aq) + 4H2KUN4(aq) + 3 CH3CH2Åh(g) → Kr2(KUN4)3(aq) + 07.002O(1) + 3 CH3CHO(g) + K2KUN4(aq)
oransjeetanol (fargeløs)grønnetanal (fargeløs)
Legg merke til at i tillegg til oksidasjon av etanol (alkohol) til etanal (aldehyd), er det en samtidig reduksjon av dikromat, som er oransje, til krom (III), eller til og med krom (II), som er grønt. Endringen i farge vil indikere at personen har mer alkohol i blodet enn tillatt.
- Sekundære alkoholer:
Dette er forbindelser der hydroksylkarbonet er bundet til to andre karbonatomer og kun ett hydrogenatom. Derfor vil det kun være ett sted i molekylet der det begynnende oksygenet kan angripe og det vil kun dannes én type produkt, som alltid vil være en keton:
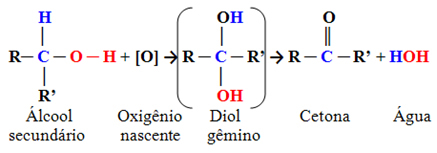
Siden karbonylkarbonet til et keton ikke har noe hydrogen bundet direkte til seg, er det ikke lenger noen mulighet for ytterligere oksidasjon. Derfor stopper reaksjonen ved ketonet.
- Tertiære alkoholer:
Tertiære alkoholer er de der karbonet som har -OH-gruppen lager tre bindinger med andre karbonatomer. Siden de ikke binder seg til hydrogener, er det ikke noe poeng på molekylet som kan angripes av begynnende oksygen. På grunn av dette faktum gjennomgår ikke tertiære alkoholer oksidasjon.
* Kilde og forfatter av bildet: CostaPPPR.
Av Jennifer Fogaça
Uteksaminert i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Oksidasjon av alkoholer"; Brasil skole. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/oxidacao-dos-alcoois.htm. Åpnet 27. juli 2021.
Kjemi

Hvordan alkometeret fungerer, alkoholkonsentrasjon, alkometer, reaksjoner som involverer etylalkohol, typer alkometer, kaliumdikromat, brenselcelle, katalysator, elektronfrigjøring, eddiksyre, hydrogen, kons