Jo høyere temperatur, jo større er reaksjonshastigheten.
Dette kan lett sees i mange situasjoner i vårt daglige liv, som i følgende eksempler:
- Når vi vil redusere nedbrytningsreaksjonen på en mat, senker vi temperaturen og plasserer den i kjøleskapet.

- Hvis vi vil øke hastigheten på tilberedningsreaksjonen til maten, er det bare å legge den i en gryte. trykk som med økende trykk også øker koketemperaturen til det flytende vannet der maten er;

- Branner er generelt ødeleggende fordi omgivelsestemperaturen øker, noe som fører til en økning i forbrenningsreaksjonens hastighet;
- For å bremse metabolske kjemiske prosesser, redusere sjansene for hjerneskade pga oksygenmangel, noen operasjoner utføres ved å senke pasientens kroppstemperatur og nå rundt 15 ° C;
- Hvis vi legger en brusetablett i et glass varmt vann og en annen i et glass kaldt vann, vil den første oppløses mye raskere.
Men hva forklarer temperaturens direkte proporsjonale innflytelse på reaksjonshastigheten?
Dette er fordi, som forklart i teksten “
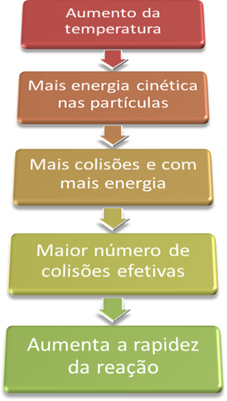
Betingelser for forekomst av kjemiske reaksjoner”, For at en reaksjon skal fortsette, er det nødvendig å tilfredsstille noen betingelser, for eksempel at partiklene de må kollidere effektivt og med minst mulig energi, som kalles aktiveringsenergi.Når vi dermed øker temperaturen i systemet, øker vi også omrøringen av de reagerende partiklene og gir dem mer kinetisk energi. Med dette vil flere kollisjoner oppstå og med mer energi, øke mengden partikler som vil reagere og følgelig øke reaksjonshastigheten.
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm

