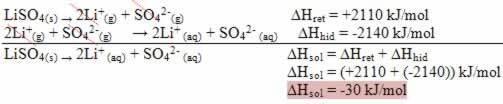
utføre beregning av entalpi av en reaksjon det betyr å bestemme energivariasjonen som oppsto fra blandingen av reaktantene til dannelsen av produktene. I ligningen nedenfor har vi representasjonen av reaktanter og produkter
A + B → C + D
A + B = Reagenser
C + D = Produkter
Hver deltaker i en reaksjon har en entalpi (H), det vil si at hver deltaker har en viss mengde energi. I løpet av reaksjonen brytes bindinger mellom reaktantene og bindinger mellom atomene i produktene dannes. På denne måten etableres en energivariasjon under den kjemiske reaksjonen.
For å bestemme beregningen av entalpien til en reaksjon, er det først nødvendig å kjenne de individuelle entalpiene til hver av deltakerne. Normalt gir øvelsene alltid entalpiverdiene til reaktanter og produkter. For eksempel:
ZnS+O2 → ZnO + SO2
HZnS = - 49,23 Kcal/mol
HO2 = 0 Kcal/mol
HZnO = - 83,24 Kcal/mol
HSO2 = - 70,994 Kcal/mol
Hvis vi hadde et enkelt stoff, ville entalpiverdien vært null. Det er imidlertid bemerkelsesverdig at hvis det enkle stoffet er en allotrop i reaksjonen, må vi være forsiktige med å vite om vi har å gjøre med den mest stabile allotropen av det kjemiske elementet som danner dette stoffet. O
allotrop mer stabil har alltid en entalpi på null, så øvelsen vil ikke utføre denne indikasjonen. Se en tabell med elementene som danner allotroper og de som er mer stabile:
MERK: Den mest stabile allotropiske formen av elementet indikerer stoffet som finnes i større mengde i naturen.
Beregningen av entalpien til reaksjonen kalles vanligvis entalpivariasjonen og er alltid representert med akronymet ∆H. Siden dette er en variasjon, innebærer å beregne entalpien til reaksjonen å trekke entalpien til produktene fra entalpien til reaktantene:
∆H = HTIL - HR
Ved å beregne entalpivariasjonen kan vi identifisere om reaksjonen er endoterm eller eksoterm. Hvis resultatet er negativt, vil reaksjonen være eksoterm; hvis resultatet er positivt, vil reaksjonen være endoterm.
∆H = - (Eksoterm)
∆H = + (endotermisk)
Når du utfører beregningen av entalpivariasjonen til en reaksjon, er det veldig viktig at vi er veldig vær oppmerksom på balansen, da entalpiverdiene gitt av øvelsen alltid er uttrykt i mol. Således, hvis reaksjonsdeltakeren har mer enn én mol, må vi multiplisere dens entalpiverdi med mengden uttrykt i balanseringen. Se et eksempel:
Ikke stopp nå... Det er mer etter reklamen ;)
2 ZnS + 3 O2 → 2 ZnO + 2 SO2
Vi observerer at koeffisientene som balanserer ligningen er 2, 3, 2 og 2. Dermed vil entalpiverdiene til hver av deltakerne være:
HZnS = - 49,23. 2 = - 98,46 Kcal/mol
HO2 = 0. 3 = 0 Kcal/mol
HZnO = - 83,24. 2 = - 166,48 Kcal/mol
HSO2 = - 70,994. 2 = - 141.988 Kcal/mol
Fra disse dataene kan vi beregne entalpivariasjonen til reaksjonen. Det er verdt å huske at verdiene til produktene må legges sammen, så vel som for reagensene:
∆H = HTIL - HR
∆H = [(-166,48) + (-141,998)] - [(-98,46) + 0]
∆H = (- 308,468) - (-98,46)
∆H = -308,468 + 98,46
∆H = - 210,008 Kcal/mol
MERK: Siden resultatet var negativt, er denne reaksjonen eksoterm.
Følg nå oppløsningen til en vestibulær øvelse for å beregne entalpien til en reaksjon:
(UFMS) Verdien av H for den balanserte ligningen nedenfor er: Data: HAg2S = -32,6 KJ/mol, HH2O = -285,8 KJ/mol, HH2S = - 20,6 KJ/mol,
2 Ag2S + 2 H2O → 4 Ag + 2 H2S + O2
a) 485,6 KJ
b) 495,6 KJ
c) 585,6 KJ
d) 595,6 KJ
e) 600 KJ
Dataene gitt av øvelsene er:
MERK: Hvordan har vi O2 i ligningen, som er den mest stabile allotropen av oksygen, er dens entalpi 0 KJ. Siden Ag er et enkelt stoff, er dets entalpi verdt 0 KJ.
HAg2S = -32,6 KJ/mol
HH2O = -285,8 KJ/mol
HH2S = -20,6 KJ/mol
Tar vi hensyn til balansen, må vi multiplisere koeffisienten med entalpien til hver av deltakerne:
HAg2S = - 32,6. 2 = - 65,2 KJ
HH2O = - 285,8. 2 = - 571,6 KJ
HH2S = - 20,6. 2 = - 41,2 KJ
HO2 = 0. 1 = 0 KJ
HAg = 0. 4 = 0 KJ
Til slutt, bruk bare dataene i entalpivariasjonsformelen:
∆H = HTIL - HR
∆H = [(0) + (-41,2) + 0] - [(-65,2) + (-571,6)]
∆H = (-41,2) - (-636,8)
∆H = -41,2 + 636,8
∆H = 595,6 Kcal/mol
Siden resultatet av variasjonen var positivt, er reaksjonen endoterm.
Av meg Diogo Lopes Dias
Kjemi

Termokjemi, entalpi, frigjort varme, eksoterm reaksjon, forbrenningsreaksjon, ytre miljø, endoterm reaksjon, reaksjon kjemi, energiutveksling, reagenser, lysutslipp, lysabsorpsjon, varme, elektrisitet, komponenter, fysisk tilstand, Produkter.