- Nøytralt medium:
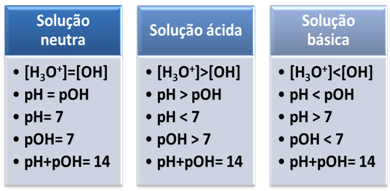
Et medium regnes som nøytralt hvis det har samme konsentrasjon, i mol/L, av hydroniumionene (H3O+) og hydroksid (OH-).
Et eksempel på et nøytralt medium som til og med fungerer som standard for andre løsninger er rent, destillert vann ved en temperatur på 25ºC. Ved denne temperaturen har den nøyaktig 1. 10-7 mol/L av begge ioner. Derfor, ditt ioniske produkt (Kw) er lik 10-14 (mol/L)2:
Kw = [H3O+]. [Åh-]
Kw = (1. 10-7 mol/L). (1. 10-7 mol/L) = 10-14 (mol/L)2
pH og pOH er gitt nedenfor:
pH= - log [H3O+] pOH= -log[OH-]
pH= - log 1. 10-7 pOH= - log 1. 10-7
pH = 7pOH = 7
Dette viser oss at i en nøytral løsning pH er lik pOH.
- Syremedium:
I et surt medium, konsentrasjonen av H-ioner3O+ er større enn for OH-ioner-.
En slik løsning kan oppnås ved å tilsette en liten del av H-ionene3O+for eksempel ved hjelp av en syre.
I følge Le Chateliers prinsipp, når en forstyrrelse forårsakes av et system i likevekt, har det en tendens til å justere seg selv for å redusere effekten av denne kraften. Dette betyr at hvis en syre tilsettes vann, vil H-ionene
3O+ de vil være i overkant og balansen vil skifte i motsatt reaksjonsretning, til venstre. Så disse overskuddsionene vil reagere med OH-ionene-. Dermed er konsentrasjonen av OH-ioner- vil avta og løsningen blir sur.Ikke stopp nå... Det er mer etter reklamen ;)

Det ioniske produktet (Kw) er alltid lik 10-14, men konsentrasjonen av H-ioner3O+ er større enn konsentrasjonen av OH-ioner-1. Derfor er pH høyere enn pOH i et surt medium, men summen er alltid lik 14.
Dessuten er konsentrasjonen av H-ioner større3O+, jo høyere pH-verdi. Ved romtemperatur (25°C), pH < 7 og pOH > 7.

- Grunnleggende betyr:
I basismediet, konsentrasjonen av OH-ioner- er større enn H-ioner3O+.
Hvis vi legger til en base til vann, betyr det at vi legger til OH-ioner.- og, som forklart i forrige punkt, ved Le Chateliers prinsipp, likevekten i reaksjonen til selvionisering av vann vil bevege seg i motsatt retning, med overflødige ioner som reagerer med H ioner3O+, redusere konsentrasjonen og gjøre løsningen grunnleggende.
I så fall vil pOH være større enn pH. Ved romtemperatur (25°C), pH > 7 og pOH < 7.

Kort:
Av Jennifer Fogaça
Uteksaminert i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Nøytrale, sure og basiske medier"; Brasil skole. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/meios-neutro-acido-basico.htm. Åpnet 27. juli 2021.


