Du nitroforbindelser er preget av tilstedeværelsen av følgende funksjonelle gruppe:
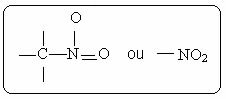
Blant derivatene er den mest kjente nitrobenzen, som er en gul, giftig, vannuløselig, tett væske som brukes som løsningsmiddel for organiske stoffer.
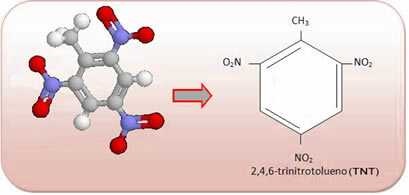
Disse forbindelsene er svært reaktive, så de er mye brukt som eksplosiver. Noen velkjente eksempler er 2-metyl-1,3,5-trinitrobenzen eller 2,4,6-trinitrotoluen (TNT), eller 2,4,6-dinitrotoluen (DNG) og trinitroglyserin (TNG), som i tillegg til å være et eksplosiv, også brukes som koronar vasodilator ved risiko for infarkt.
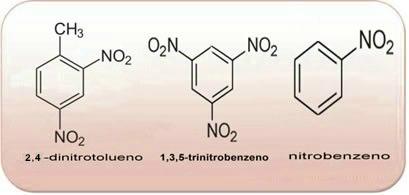
Forbindelsene ovenfor er alle aromatiske, jo større mengde NO2 i sine molekyler, jo mer eksplosiv vil den være. Deres preparater og egenskaper er svært forskjellige fra alifatiske nitroforbindelser. Nitroalkaner er fargeløse, polare væsker, også uløselige i vann og brukes i organiske synteser, som mellomprodukter og som løsemidler.
Nomenklaturen for nitroforbindelser følger regelen nedenfor, etablert av International Union of Pure and Applied Chemistry (IUPAC):

Dermed har vi følgende navn for nitroforbindelsesstrukturene nedenfor:
H3Ç__PÅ2: nitrometan
H3Ç__CH2__PÅ2: nitroetan
H3Ç__CH2__ CH2__PÅ2: 1- nitropropan
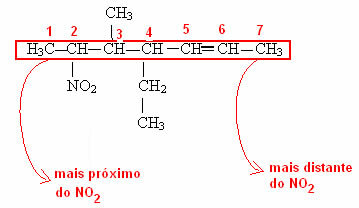
Merk i det siste eksemplet at det var nødvendig å nummerere hvor den funksjonelle gruppen til karbonkjeden kommer fra. Denne nummereringen gjøres alltid fra den nærmeste enden av funksjonsgruppen. Se hvordan dette gjøres i eksemplet nedenfor:
Av Jennifer Fogaça
Uteksaminert i kjemi
Kilde: Brasil skole - https://brasilescola.uol.com.br/quimica/nitrocompostos.htm



